
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения молекулярно-кинетической теории
|
|
|
|
Молекулярная физика – раздел науки, посвященный изучению свойств тел на основе трех положений молекулярно-кинетической теории:
1. Вещество состоит из атомов или молекул.
2. Молекулы движутся беспорядочно, с различными по величине и направлению скоростями.
3. Молекулы взаимодействуют между собой, взаимодействие состоит в притяжении и отталкивании.
Выдающиеся учёные древней Греции - Демокрит и Аристотель высказали догадку о строении вещества из атомов. Современная молекулярная физика берёт свое начало в трудах М.В. Ломоносова. Он ввёл понятие корпускулы - молекулы и сформулировал основные молекулярно - кинетические представления.
Свойства газов, жидкостей и твердых тел описываются на основе изучения молекулярной картины их строения. В молекулярной физике используются методы физической статистики, термодинамики и физической кинетики.
Термодинамический метод основан на использовании трёх опытных законов, называемых началами.
Методами кинетической физики изучаются процессы переноса энергии, импульса, заряда и вещества в различных физических средах (газе, плазме, жидкости и твёрдом теле). Эти методы позволили разработать кинетическую теорию идеальных и реальных газов, теорию явлений переноса, а также процессы фазовых переходов (переходов между различными состояниями вещества, например, из жидкой фазы в газообразную, из твёрдой фазы в жидкую и т.д.).
Французский физик Ж. Перрен при изучении броуновского движения частиц вещества, взвешенных в газообразной или жидкой среде, доказал существование молекул и вычислил число молекул в моле вещества. Броуновское движение является результатом теплового движения молекул среды и объясняется молекулярно - статистической теорией Эйнштейна - Смолуховского.
|
|
|
Перрен Жан Батист (1870 - 1942), французский физик и физико - химик, родился в Лилле, окончил Нормальную школу. Изучал броуновское движение. Экспериментально доказал, что катодные лучи являются потоком отрицательно заряженных частиц. Работы посвящены исследованию рентгеновских лучей, проводимости газов, радиоактивности, атомной физике, акустике.
Распределение молекул по скоростям было получено теоретически в работах Д. Максвелла и подтверждено в опытах О. Штерна. Теория взаимодействия молекул возникла при изучении капиллярных явлений.
И.Д. Ван-дер-Ваальс объяснил свойства реальных газов и жидкостей на основе теории взаимодействия молекул. В дальнейшем учение о межатомных взаимодействиях разрабатывалось методами квантовой механики в работах М.Борна, Лондона, В. Гайтлера и П.Дебая.
Основные величины, характеризующие массу, размер и число молекул в веществе:
1. Относительная атомная масса: 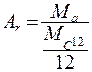 - отношение массы атома к одной двенадцатой части массы атома изотопа углерода
- отношение массы атома к одной двенадцатой части массы атома изотопа углерода 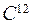 . Это безразмерная величина, она характеризует число протонов и нейтронов в атоме, т.к. масса электрона значительно меньше массы нуклона.
. Это безразмерная величина, она характеризует число протонов и нейтронов в атоме, т.к. масса электрона значительно меньше массы нуклона.
2. Относительная молекулярная масса:  - это отношение массы молекулы
- это отношение массы молекулы  к одной двенадцатой части массы изотопа углерода
к одной двенадцатой части массы изотопа углерода 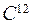 . Относительная молекулярная масса также является безразмерной величиной.
. Относительная молекулярная масса также является безразмерной величиной.
3. Относительная молекулярная масса вещества, состоящего из нескольких химических элементов:  , где
, где  - число атомов i - го химического элемента;
- число атомов i - го химического элемента; 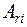 - относительная атомная масса этого элемента.
- относительная атомная масса этого элемента.
Пример: Относительная молекулярная масса углекислого газа 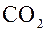 :
:
 .
.
4. Число Авогадро  число атомов в двенадцати граммах изотопа углерода
число атомов в двенадцати граммах изотопа углерода 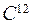 :
:
5. Количество вещества n - это отношение числа атомов или молекул в веществе к числу Авогадро:  или
или  . Размерность количества вещества:
. Размерность количества вещества:  моль. Моль - количество вещества, в котором содержится число частиц, равное числу Авогадро.
моль. Моль - количество вещества, в котором содержится число частиц, равное числу Авогадро.
|
|
|
6. Молярная масса m - масса моля вещества: 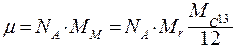 . Молярная масса численно равна относительной молекулярной массе, но является размерной величиной. Размерность молярной массы:
. Молярная масса численно равна относительной молекулярной массе, но является размерной величиной. Размерность молярной массы:  .
.
7. Эффективный диаметр молекулы  - наименьшее расстояние между центрами молекул при их сближении. Размер молекул составляет несколько Ангстрем (
- наименьшее расстояние между центрами молекул при их сближении. Размер молекул составляет несколько Ангстрем (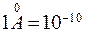 ).
).
8. Концентрация молекул n - отношение числа молекул в веществе к занимаемому объему V:  . Размерность
. Размерность  .
.
9. Плотность вещества r - масса единицы объема вещества: 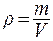 . Размерность
. Размерность  .
.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 550; Нарушение авторских прав?; Мы поможем в написании вашей работы!