
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Галогенопроизводные предельных углеводородов
|
|
|
|
Галогенопроизводные предельных углеводородов
(галогеналкилы)
Общая формула предельных моногалогенопроизводных CnH2n+1X, где Х-галоген. Атом галогена может находиться при первичном, вторичном или третичном углеродном атоме (первичные, вторичные и третичные галогенопроизводные).
Поляризация связи С–Х в галогеналкилах способствует замещению галогена X на другие атомы или группы атомов при действии на них нуклеофильными реагентами (отрицательно заряженными ионами или молекулами, имеющими неподеленную пару электронов):
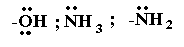 и другие.
и другие.
Схематично реакцию нуклеофильного замещения можно представить так:

нуклеофил(уходящая группа)
Из галогеналкилов получают многие классы органических соединений: спирты, амины, нитро- и магнийорганические соединения, эфиры (простые и сложные) и др.
Ниже приведены свойства галогеналкилов, из которых видно, что фтор, хлор, бром и йод производные имеют разные реакционные способности.
| Связь | Длина, | Энергия, | Поляризуемость, |
| н х м | ккал/моль | см3 х моль | |
| С-F | 0,142 | 1,44 | |
| С-С1 | 0,172 | 6,51 | |
| С-Вг | 0,191 | 9,39 | |
| С-I | 0,212 | 14,61 |
При переходе от фтора к йоду наблюдается:
1. Рост атомных радиусов.
2. Ослабление связи внешних электронов с ядром.
З. Рост влияния внешнего электрического поля.
4. Рост реакционной способности.
Скорость нуклеофильного замещения зависит также от строения радикалов, связанных с галогеном, основности нуклеофильной частицы, величины положительного заряда на атакуемом атоме углерода и природы растворителя.
При нуклеофильном замещении реакции могут протекать по двум различным механизмам, условно обозначаемым SN1 и SN2:
SN
|
|
|
SN1: Мономолекулярное SN2: Бимолекулярное
нуклеофильное замещение, нуклеофильное замещение
(реакция первого порядка). (реакция второго порядка).
Скорость течения реакции Скорость течения реакции
зависит только от концент- зависит от концентрации
рации алкилгалогенида обоих компонентов (алкилга-. логенида и нуклеофила).
SN1-замещение представляет собой двустадийный процесс. Первая стадия - протекает медленно с образованием устойчивого карбкатиона. Вторая стадия - взаимодействия карбкатиона с нуклеофильной частицей. Скорость реакции определяется скоростью наиболее медленной стадии(1), скоростью диссоциации RХ:

По механизму SN1наиболее активно протекают реакции с третичными галогенопроизводными, т.к. при диссоциации образуется наиболее устойчивый третичный карбкатион.
SN2- замещение представляет собой одностадийный процесс с образованием переходного состояния: нуклеофильный реагент приближается к электрофильному атому углерода со стороны, противоположной той, где находится атом галогена. Связь углерод–галоген удлиняется и ослабляется, в то время как связь углерод–нуклеофил частично образовывается:

Разрыв связи С–X и образование новой связи углерод - нуклеофил происходит одновременно, поэтому эту реакцию называют согласованным или синхронным процессом. Нуклеофил атаковал атом углерода со стороны, противоположной той, где находился заместитель X.
Реакция протекает по механизмуSN2 только в том случае, если нуклеофил может легко подойти к алкилгалогениду и образовать с ним переходное состояние, например, с первичными алкилгалогенидами, имеющими нормальную цепь углеродных атомов. Разветвленный углеродный скелет тормозит подход нуклеофила.
Если галоген находится в боковой цепи ароматического углеводорода, например C6 H5–CH2–X,то довольно легко вступает в реакции нуклеофильного замещения и по механизмуSN1 и по SN2:
|
|
|

Возможность протекания реакции по механизму SN1 объясняется высокой устойчивостью катиона, который возникает при отщеплении галогена:

Сопряженный устойчивый
карбкатион
Далее, образовавшийся устойчивый карбкатион может взаимодействовать с нуклеофильным реагентом:
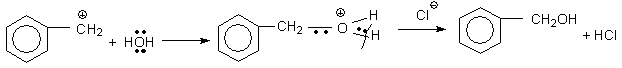
Возможность протекания этой же реакции по механизму SN2 связана с малой энергией образующегося переходного состояния:

|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1476; Нарушение авторских прав?; Мы поможем в написании вашей работы!