
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы и формулы к выполнению задачи по теме №2
|
|
|
|
ТЕМА №2. МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Основы молекулярно-кинетической теории
1. Основное уравнение молекулярно-кинетической теории:
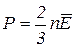 , (2.1)
, (2.1)
где n – концентрация молекул газа, 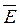 – средняя кинетическая энергия молекул.
– средняя кинетическая энергия молекул.
2. Средняя кинетическая энергия молекул:
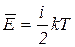 , (2.2)
, (2.2)
где k – постоянная Больцмана, i – число степеней свободы, Т – температура.
3. Количество вещества:
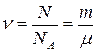 , (2.3)
, (2.3)
где N – число частиц в газе, NA – число Авогадро, m – масса газа, μ – молярная масса газа.
4. Плотность газа, занимающего объем V:
 . (2.4)
. (2.4)
5. Уравнение Менделеева-Клапейрона:
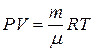 , (2.5)
, (2.5)
где P – давление, V – объем газа, μ – молярная масса газа, R – универсальная газовая постоянная, Т – температура газа.
Термодинамика
6. Связь между молярной С и удельной с теплоемкостями:
 . (2.6)
. (2.6)
7. Молярная теплоемкость при постоянном объеме:
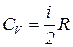 . (2.7)
. (2.7)
8. Уравнение Майера:
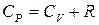 , (2.8)
, (2.8)
где CP – молярная теплоемкость при постоянном давлении
9. Первое начало термодинамики:
 , (2.9)
, (2.9)
где Q – количество теплоты, сообщенное системе (газу); ΔU – изменение внутренней энергии газа; А – работа, совершенная газом против внешних сил.
10. Изменение внутренней энергии газа:
 . (2.10)
. (2.10)
11. Работа, совершаемая при изменении объема газа:
 . (2.11)
. (2.11)
12. Уравнения адиабатического процесса:
 ; т.е.
; т.е.  ; (2.12)
; (2.12)
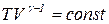 ; т.е.
; т.е. 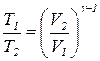 . (2.13)
. (2.13)
γ – коэффициент Пуассона  .
.
13. Коэффициент полезного действия любого термодинамического цикла:
 , (2.14)
, (2.14)
где А – работа цикла, Q1 – количество теплоты, полученного рабочим телом от нагревателя, или
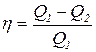 , (2.15)
, (2.15)
где Q2 – теплота, переданная рабочим телом охладителю.
14. Коэффициент полезного действия идеального цикла Карно:
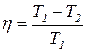 , (2.16)
, (2.16)
где Т1 и Т2 – температуры нагревателя и охладителя.
15. Изменение энтропии:
|
|
|
 , (2.17)
, (2.17)
где А и В – пределы интегрирования, соответствующие начальному и конечному состояниям системы.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 554; Нарушение авторских прав?; Мы поможем в написании вашей работы!