
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимые и необратимые процессы
|
|
|
|
Одним из важных понятий термодинамики, вообще, и термодинамики газовых потоков, в частности, является понятие об обратимых и необратимых процессах. Процесс перехода системы из состояния 1 в состояние 2 является обратимым, если возвращение этой системы из состояния 2 в исходное состояние 1 может быть осуществлено таким образом, что в результате прямого и обратного процесса во внешней среде не произойдет никаких изменений. Если же в результате прямого и обратного процесса во внешней среде изменения происходят, то такой прямой процесс является необратимым.
Для выяснения особенностей обратимых и необратимых процессов и установления их признаков рассмотрим некоторые примеры.
Равновесное расширение газа в цилиндре без трения (рис. 2.12). Примем, что в цилиндре находится 1 кг газа и расширение его происходит изобарно (1 - 2). Газ, расширяясь при давлении р, поднимает поршень весом P n = pF, где F - площадь поршня. Работа, совершаемая газом в этом процессе, равна: l 1-2 = p·F·h = p (υ 2 – υ 1), а теплота, подведенная к газу q 1-2 = cp (T 2– T 1). При проведении процесса в обратном направлении (2 - 1) для возвращения системы в исходное состояние груз, опускаясь, сообщит газу точно такую же работу l 2-1 = l 1-2, и во внешнюю среду будет отведено тепло q 2-1 = q 1-2. Здесь рассматриваются абсолютные величины l и q.
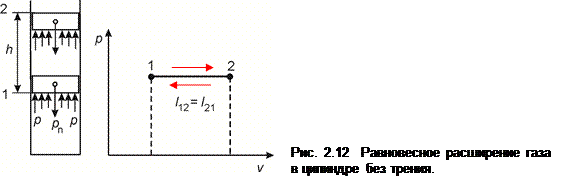 |
Таким образом, в результате прямого (1 - 2) и обратного (2 - 1) процессов система (газ-поршень) возвратится в исходное состояние, причем во внешней среде не произойдет никаких изменений, т. к. работа и теплота в прямом и обратном процессах одинаковы по величине. Следовательно, данный процесс расширения газа является обратимым. Очевидно, что такой результат может быть получен лишь при условии равновесного (квазистатического) протекания процесса, когда сила давления газа на поршень равна силе, с которой поршень сжимает газ. Следовательно, важным условием обратимого процесса является его равновесность.
|
|
|
Расширение газа в цилиндре при наличии трения поршня о стенки цилиндра (p = const). Пусть давление газа такое же, как и в предыдущем случае при обратимом расширении газа. Тогда вес поршня P n*, который может быть поднят, будет меньше P n* = P n – P тр., где P тр. – сила трения. Полезная работа, совершенная газом в этом случае, будет равна l *1-2 = P n* h. Очевидно, что по абсолютной величине она меньше, чем при отсутствии трения l *1-2 < l 1-2. Работа, которую надо совершить, чтобы вернуть систему в исходное состояние, должна быть равна:
l *2-1 = (p·F + P тр) h.
Из сказанного следует, что l *2-1 > l *1-2, т.е. для возвращения системы в исходное состояние в обратном процессе должна быть произведена дополнительная работа Δ l * = l *2-1 – l *1-2, что неизбежно приведет к изменению состояния внешней среды. Следовательно, рассматриваемый процесс является необратимым.
Из приведенного примера видна характерная особенность необратимого процесса, заключающаяся в том, что полезная работа в этом процессе меньше той, которую можно было бы получить при обратимом протекании процесса на величину Δ l = l 1-2 – l *1-2. Потеря работы при необратимых процессах, связанная с их необратимостью, называется диссипацией (рассеянием) энергии. Согласно первому закону термодинамики общее количество энергии при этом не уменьшается, однако работоспособность системы из-за необратимости процесса уменьшается.
Трение вызывает необратимость любых механических процессов. В качестве другого такого примера можно привести течение газа или жидкости с трением, т.к. трение в потоке всегда приводит к диссипации энергии, хотя и не уменьшает общий запас энергии потока (работа трения переходит в теплоту). Однако величина полезной работы, которую газ способен совершить при этом, становится меньше. Эффекты, (например, трение), делающие процессы необратимыми, называются диссипативными.
|
|
|
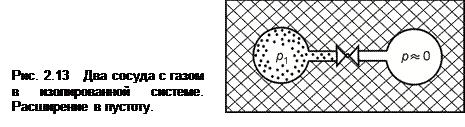
Расширение газа в вакуум. Рассмотрим изолированную систему, показанную на рис. 2.13. Вначале газ с давлением р 1 занимает левый сосуд, а правый сосуд практически пуст (р ≈ 0). Если открыть вентиль, то газ, расширяясь, будет перетекать в правый сосуд. После установления равновесия давление газа станет одинаковым в обоих сосудах и равным р 2 < р 1. Очевидно, что газ, расширяясь, не совершает никакой полезной работы. Однако для возвращения системы в исходное состояние, т.е. для возвращения всего газа в левый сосуд, потребуется некомпенсированная работа сжатия, подведенная извне. Следовательно, данный процесс является необратимым.
 |
Передача теплоты от тела с более высокой температурой к телу с меньшей температурой. Многовековая практика человечества показывает, что если передача тепла от горячего тела к холодному может проходить самопроизвольно, то обратный переход возможен лишь при затрате энергии извне, т.е. при изменении состояния внешней среды. Таким образом, охлаждение тела является необратимым процессом.
Течение электрического тока по проводникам. Оно сопровождается необратимыми потерями электроэнергии на преодоление электрического сопротивления (выделение джоулевой теплоты).
Важно иметь в виду, что любой самопроизвольный процесс (расширение газа в пустоту, передача теплоты от горячего тела к холодному) является необратимым. Действительно, любой самопроизвольный процесс протекает до тех пор, пока в системе не установится равновесие. Система, достигшая равновесного состояния, не способна к самопроизвольному выходу из этого состояния; иначе говоря, обратный процесс по отношению к данному самопроизвольному может быть осуществлен лишь путем подвода энергии извне, что связано с изменением состояния внешней среды. Сказанное подтверждает, что любой самопроизвольный процесс является необратимым. Вместе с тем заметим, что самопроизвольные процессы, как это следует из сказанного, являются неравновесными, ибо самопроизвольное протекание процесса возможно лишь при отсутствии равновесия в системе.
|
|
|
Следует заметить, что все процессы, протекающие в природе или в технических устройствах, в той или иной мере являются необратимыми из-за конечной скорости их протекания (ведущей к неравновесности) или из-за наличия диссипативных эффектов, например, трения. Поэтому обратимые процессы по отношению к реальным необратимым являются в определенном смысле идеальными, обладающими наибольшим совершенством и отсутствием потерь работы из-за необратимости. Обратимые процессы можно рассматривать как предельные, по которым оценивается качество реальных процессов.
Контрольные вопросы
1. Дайте определение первого закона термодинамики и запишите его математические формулировки.
2. В чем сущность внутренней энергии системы? В чем различие внутренней энергии для идеального и реального газа?
3. Что такое работа и теплота? Что между ними общего и чем они различаются?
4. Покажите, что площадь под кривой процесса в p – v координатах численно равна работе процесса.
5. Что такое энтальпия, в каких единицах она измеряется? Приведите уравнения, характеризующие изменение внутренней энергии и энтальпии.
6. В чем состоят основные задачи исследования термодинамических процессов?
7. Дайте анализ основных термодинамических процессов идеального газа в p – v координатах. Запишите уравнения для работы и количества теплоты, изменения внутренней энергии и энтальпии в этих процессах. В каком процессе вся подведенная теплота превращается в работу?
8. Дайте определение политропного процесса. Запишите уравнение для показателя политропы.
9. Дайте анализ различных групп политропных процессов расширения и сжатия в p – v координатах.
10. Что такое обратимый термодинамический процесс и обратимый цикл? Приведите примеры необратимых процессов в технике.
РАЗДЕЛ 3
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1413; Нарушение авторских прав?; Мы поможем в написании вашей работы!