
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика. 2 страница
|
|
|
|
299. 2Н2О2 = 2Н2О + О2. Пероксид водорода разлагается при комнатной температуре, т.к. при этом получаются еще более устойчивые вещества. ΔGреакции = 2ΔG(Н2О) - 2ΔG(Н2О2) = -2*241.8 + 2*187.8 = -108 кДж/моль, т.е. реакция термодинамически возможна.
300. Энергию Гиббса часто называют «свободной» энергией, т.к. она является функцией давления и температуры, т.е. параметров, которые можно свободно менять и фиксировать. Для окислительно-восстановительных реакций энергия Гиббса определяется уравнением: ΔG = -z*F*E, где z - количество электронов, F - постоянная Фарадея, E - электродвижущая сила.
301. Скорость химической реакции по некоторому компоненту называется изменение количества этого компонента в единицу времени в единице реакционного пространства. На практике скорость реакции может определяться по различным параметрам: по изменению концентрации одного из веществ, по изменению цветности, рН, электропроводности и др. Скорость реакции - это кинетическая характеристика, а энергия Гиббса - термодинамическая характеристика, эти параметры между собой не связаны. Т.к. скорость реакции определяется концентрациями реагирующих веществ, которые постоянно изменяются, то ее определяют на данный момент времени.
302. Основным понятием химической кинетики является понятие о скорости химической реакции. Математическое выражение скорости реакции зависит от типа реакции: гетерогенная или гомогенная. Поэтому в кинетике проводится такое разделение реакций.
гомогенные: N2(г)+O2(г) = 2NO2(г), N2O4 (г) = 2 NO2 (г);
гетерогенные: Ca(тв) + 2H2O(ж) = Ca(OH)2(ж) + H2(г), CuO(тв) = Cu(тв) + 1/2O2(г).
303. Одной из основных задач химической кинетики является нахождение зависимости скорости реакции от концентраций реагирующих веществ (кинетическое уравнение). Для простой реакции кинетическое уравнение находится легко, в то время как для сложной реакции нахождение кинетического уравнения представляет собой очень сложную задачу. Поэтому принято разделение реакций на простые и сложные.
|
|
|
Простые реакции. Моно: Cl2 = 2Cl, Би: Н+ + Сl- = HCl, Три: 3O2 = 2O3.
Сложные реакции: Последовательные: 2Ca + O2 = 2CaO => CaO + H2O = Ca(OH)2, Параллельные: Ca + Cl2 = CaCl2 и Ca + F2 = CaF2, Цепные: Сl2 = 2Cl*, Cl* + CH4 = CH3* + HCl, CH3* + Cl2 = CH3Cl + Cl* и т.д.
По стехиометрическому уравнению нельзя однозначно определить - сложная это реакция или простая, но если в реакцию вступают более трех частиц, то эта реакция сложная.
304. На скорость реакции влияют: природа взаимодействующих частиц, температура, давление, катализатор и др.
305. Кинетическое уравнение для простой и сложной реакции записывается как зависимость скорости реакции от концентрации взаимодействующих веществ. Однако, если для простой реакции кинетическое уравнение имеет относительно простой вид, то для сложных реакций кинетическое уравнение может записываться в виде системы уравнений. Константа скорости реакции - это скорость реакции при концентрации веществ равных единице. На константу скорости влияет температура, давление, природа веществ и не влияет концентрация веществ и объем системы.
306. а) 2HI = H2 + I2, V = К*Р2(HI) , после увеличения давления в 2 раза V/ = К*(2Р(HI))2 , в результате скорость возрастет в V/ / V = 4 раза.
Б) N2O4 = 2NO2, V = К*Р (N2O4), после увеличения давления в 2 раза V/ = К*(2Р(N2O4)), в результате скорость возрастет в V/ / V = 2 раза.
В) 2NO +H2 = N2O + H2O, V = К*Р2(N2O) *P(H2), после увеличения давления в 2 раза V/ = К*(2Р(N2O)) 2 *2P(H2), в результате скорость возрастет в V/ / V = 8 раз.
307. a) 2NO +Cl2 = 2NOCl, V = К*Р2(NO)*P(Cl2), после увеличения давления в 3 раза V/ = К*(3Р(NO))2 * 3P(Cl2), в результате скорость возрастет в V/ / V = 27 раз.
Б) H2 + OH= H2O + H, V = К*Р(OH)*P(H2), после увеличения давления в 3 раза V/ = К*3Р(OH)*3P(H2), в результате скорость возрастет в V/ / V = 9 раз.
|
|
|
В) Cl2 = 2Cl, V = К*P(Cl2), после увеличения давления в 3 раза V/ = К*3P(Cl2), в результате скорость возрастет в V/ / V = 3 раза.
308. а) O2+H = OH + O, V = К*Р(H) *P(O2), после увеличения давления в 4 раза V/ = К*4Р(H) *4P(O2), в результате скорость возрастет в V/ / V = 16 раз.
Б) H2+Y2 = 2HY, V = К*Р(H2)*P(Y2), после увеличения давления в 4 раза V/ = К*4Р(H2)*4P(Y2), в результате скорость возрастет в V/ / V = 16 раз.
В) 2NO+O2 = 2NO2, V = К*Р2(NO2)*P(O2), после увеличения давления в 4 раза V/ = К*(4Р(NO2) )2 *4P(O2), в результате скорость возрастет в V/ / V = 64 раза.
309. H2+Br2 = 2HBr, V = K*[H2]*[Br2]1/2 .Молекулярность реакции равна1+1 =2, а порядок реакции 1+1/2=1,5. Поскольку молекулярность и порядок не совпадают, то данная реакция - сложная. А) V/=K*4[H2]*[Br2]1/2 , скорость реакции возрастает в V/ / V= 4 раза.
Б) V//=K*[H2]*(4[Br2])1/2 , скорость реакции возрастает в V// / V= 2 раза.
В) V///=K*4[H2]*(4[Br2])1/2 , скорость реакции возрастает в V// / V= 8 раз.
310. F2+ 2ClO2=2ClO2F, V=K*[F2]*[ClO2], Данная реакция является сложной, т.к. ее порядок (2) и молекулярность (3) не совпадают. При увеличении давления в 3 раза: V/ = K*3[F2]*3[ClO2], скорость реакции возрастает в V/ / V = 9 раз.
311. 2NO +2H2 = N2 + 2H2O, а) фиксируем концентрацию [H2] = 0,12 моль/л. При увеличении [NO] в 2 раза, скорость реакции возрастает в 4 раза, т.е. порядок по[NO] равен 2. б) фиксируем [NO] = 1,12 моль/л. При увеличении [H2] в 2 раза, скорость возрастает в 2 раза - порядок по [H2] = 1. Т.о. кинетическое уравнение имеет вид: V = K*[H2]1 *[NO]2.
312. SO2+2H2=S+2H2O, а) фиксируем концентрацию [SO2]=200. При увеличении [H2] в 2 раза, скорость реакции возрастает в 2 раза, т.е. порядок по[H2] равен 1. б) фиксируем [H2]=200. При увеличении [SO2] в 2 раза, скорость возрастает в 2 раза - порядок по [SO2]=1. Т.о. кинетическое уравнение имеет вид: V=K*[H2]1 *[SO2]1.
313. 2Co+3 + Tl+ = 2Co+2 + Tl+3,
а) фиксируем концентрацию [Co+3] = 0,3моль/л. При увеличении [Tl+] в 2 раза, скорость реакции возрастает в 2 раза, т.е. порядок по [Tl+] равен 1.
б) фиксируем [Tl+] = 0,1 моль/л. При увеличении [Co+3] в 3 раза, скорость возрастает в 3 раза - порядок по [Co+3] = 1. Т.о. кинетическое уравнение имеет вид: V = K*[ Co+3]1 *[Tl+]1.
314. CH3CHO = CH4+CO. При увеличении [CH3CHO] в 2 раза, скорость возрастает в 4 раза, т.е. порядок равен 2. V=K* [CH3CHO]2.
315. 2A+3B=A2B3. а) фиксируем концентрацию [A] = 0,20 моль/л. При увеличении [В] в 4 раза, скорость реакции возрастает в 4 раза, т.е. порядок по [В] равен 1. б) фиксируем [В] = 0,80 моль/л. Изменение [A] не приводит к изменению скорости. Т.о. кинетическое уравнение имеет вид: V = K*[В]1 . После увеличения давления в 2 раза V/ = K*2[В], скорость реакции возрастает в 2 раза: V/ / V = 2 раза.
|
|
|
316. 2NO+O2 = 2NO2, Кинетическое уравнение: V = K*[NO]2*[O2]1. 1.2*10-3 = К*0.32 *0.15, следовательно, К = 0,089 л2/моль2с.
317. H2+Y2 = 2HY, К = 0,16, [H2] = 0,04, [I2] = 0,05 моль/л. Vисх. = K*[H2]*[I2] = 0,16*0,04*0,05 = 3,2*10-4. Когда израсходовалась половина количества водорода, т.е. 0,02 моль/л, то израсходовалось столько же иода. Осталось 0,02 моль/л водорода и 0,03 моль/л иода. V/ = 0,16*0,02*0,03 = 9,6*10-5.
318. 2NO+Cl2 = 2NOCl, [NOисх.] = 0,4 моль/л, [Cl2 исх.] = 0,3 моль/л. V = K*[NO]2 * [Cl2] = К*0,42 *0,3 = 0,048К. Прореагировало 0,2 моль/л NO, следовательно, прореагировало 0,1 моль/л Cl2. Осталось 0,2 моль/л NO и 0,2 моль/л Cl2. V = K * 0,22 * 0,2 = 0,008 К. Скорость уменьшилась в 0,048/0,008 = 6 раз.
319. Согласно правилу Вант-Гоффа, при повышении температуры на 100 скорость реакции увеличивается в 2-4 раза. γ = 3, Т1 = 800С, Т2 = 1300С. V2/V1 = γТ2 -Т1 / 10 = 3130-80 /10 = 243.
320. Температурный коэффициент показывает, во сколько раз увеличивается скорость химической реакции при увеличении температуры на 10 градусов. γ = 3, ∆Т = 40, V2/V1 = γТ2 -Т1 / 10 = 340 /10 = 81.
321. Согласно правилу Вант-Гоффа, при повышении температуры на 100 скорость реакции увеличивается в 2-4 раза. γ = 1.8, V2/V1 = 50. ∆Т -?
V2/V1 = γ ∆Т/10, 50 = 1.8 ∆Т/10, ln50 = ∆Т/10 *ln1.8, ∆Т = 66.50C.
322. Правило Вант-Гоффа выведено не из фундаментальных законов, а опытным путем, поэтому оно называется эмпирическим. Оно справедливо для всех реакций, кроме ферментативных и реакций третьего порядка. Т1 = 1000, Т2 = 1500, К1 = 6*10-4, К2 = 7.2*10-2. К2 / К1 = γ ∆Т / 10 , 7.2*10-2 / 6*10-4 = γ (150-100)/10 , γ = 2.6.
323. Т1=1200, Т2=1700, К1=5,9*10-4, К2=6,7*10-2. К2 / К1 = γ ∆Т / 10 , 6,7*10-2 / 5,9*10-4 = γ 170-120/10 , γ = 2,6.
324. γ1 = 3, γ2 = 4, при температуре Т1 : К1/ = К2/. При температуре Т2: К2// / К1// = 5. ∆Т -?
К2 / К1 = γ ∆Т / 10 . К1// / К1/ = γ1 ∆Т / 10 (1) . К2// / К2/ = γ2 ∆Т / 10 (2). Разделим выражение (1) на выражение (2), получим: К1// / К2// = (γ1 ∆Т / 10) / (γ2 ∆Т / 10). 1/5 = (3 ∆Т / 10 ) / (4 ∆Т / 10). ln5 + (∆Т / 10) *ln3 = (∆Т / 10) * ln4, ∆Т = 560.
325. Уравнение Аррениуса определяет зависимость константы скорости химической реакции от температуры.  , К = К0 * е -Е а / RT .
, К = К0 * е -Е а / RT .
Т1 = 288К, К1 = 3,1*10-4. Т2 = 313 К, К2 = 8,2*10-3.
|
|
|
ln(K2/K1) = Ea/R * (1/T1 - 1/T2).
ln(8,2*10-3 / 3,1*10-4) = Еа / 8,31 * (1/288 - 1/313), следовательно, Еа = 98,14 кДж/моль.
326. Дополнительная энергия, необходимая для протекания между частицами химической реакции, называется энергией активации. Т1 = 673К, К1 = 2,2*10-4. Т2 = 973 К, К2 = 8,33. ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(8,33 / 2,2*10-4) = Еа / 8,31 * (1/673 - 1/973), Еа = 191,4 кДж/моль.
327. Еа = 100 кДж/моль Т1 = 273К, К1 = 2,0*10-2. Т2 = 373 К, К2 =?. ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(К2 / 2,0*10-2) = 100000 / 8,31 * (1/273 - 1/373), К2 = 2712.
328. а) 2NO = N2 + O2, Еа = 290 кДж/моль Т1=300К, Т2=310 К, К2 / К1 =?. ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(К2 / К1) = 290000 / 8,31 * (1/300 - 1/310), К2 /К1 = 43.
Б) 2NO + O2 = 2NО2, Еа = 10 кДж/моль Т1=300К, Т2=310 К, К2 / К1 =?. ln(K2/K1) = Ea/R * (1/T1 - 1/T2). ln(К2 / К1) = 10000 / 8,31 * (1/300 - 1/310), К2 /К1 = 1,14.
Изменение скоростей данных реакций не согласуется с правилом Вант-Гоффа.
329. ЕА1 = 184 кДж/моль, ЕА2 = 107 кДж/моль, пусть Т=400 К. К1 = К0 * е -Е А1 / RT , К2 = К0 * е -Е А2 / RT , 
 , К2 / К1 =1,15*1010 раз.
, К2 / К1 =1,15*1010 раз.
330.
| Процесс | Катализаторы |
| Синтез аммиака из N2 и Н2 | Fe + K2O, Al2O3, MgO |
| Синтез спиртов из СО и Н2 | ZnO-Cr2O3, CuO-ZnO- Cr2O3 |
| Синтез углеводородов из СО и Н2 | Fe, Ni, Co+MgO |
| Риформинг | Pt/ Al2O3 |
| Гидратация олефинов | H3PO4 на носителях |
| Производство серной кислоты | Оксид ванадия (V) |
| Производство азотной кислоты | Платинородиевые сетки |
| Гидратация этилена | H3PO4 и H2SO4 |
| Производство полиэтилена | Al(C2H5)3 и TiCl4 |
Катализаторы используют для увеличения скорости реакции, повышения ее селективности, конверсии и выхода целевого продукта.
ЕА1 = 200 кДж/моль, ЕА2 = 100 кДж/моль, Т=400 К. К1 = К0 * е -Е А1 / RT , К2 = К0 * е -Е А2 / RT , 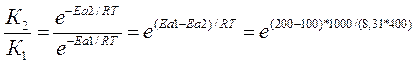
 , К2 / К1 = 1,16*1013 раз.
, К2 / К1 = 1,16*1013 раз.
331. С точки зрения химической термодинамики, химическое равновесие характеризуется постоянством концентраций веществ во времени. Согласно химической кинетике, равновесие определяется равенством скоростей прямой и обратной реакций.
А) N2 (г) + 3H2 (г) = 2NH3 (г), 
Б) Fe3O4 + 4CO (г) = 3Fe (к) + 4CO2 (г), 
332. Константа химического равновесия - это отношение произведения концентраций продуктов химической реакции к произведению концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
А) 4HCl + O2 (г)= 2Cl2(г) + 2H2O (г), 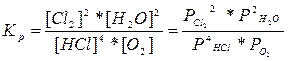
Б) CaO (k) + H2O (г) = Сa(OH)2 (к), 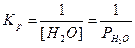
333. Состояние реакции, при котором концентрации веществ не изменяются во времени, называется равновесным. Основные признаки: если на реакцию, находящуюся в состоянии химического равновесия оказать воздействие, то система перейдет в новое равновесное состояние, уменьшающее это воздействие. Если воздействие снять, то реакция вернется к исходному состоянию.
А) CO(г) + H2O(г) = CO2(г) + H2(г) 
Б) 2CuO(к) = 2Cu(к) + O2(г) 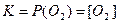
334. При истинном равновесии химическая реакция характеризуется постоянством концентраций всех веществ в течение сколь угодно долгого промежутка времени. При этом реакция подчиняется принципу Ле Шателье. При ложном химическом равновесии с течением времени концентрации веществ могут меняться, и реакция не подчиняется принципу Ле Шателье.
А) 3O2(г) = 2О3 (г), 
Б) Na2CO3 (к) + CO2(г) + H2O(г) = 2NaHCO3(к), 
335. Закон действующих масс: константа равновесия химической реакции равна отношению произведения концентраций продуктов реакции к произведению концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам: аА + bB = cC + dD, 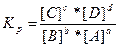 .
.
А) N2 (г) + О2 (г) = 2NО(г),  ,
,
Б) 3Fe(к) + 4H2O(г) = Fe3O4(к) + 4H2(г), 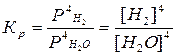 .
.
336. На величину константы химического равновесия влияют: природа реагирующих веществ, температура, давление.
А) Y2 (г) + H2 (г) = 2HY (г), 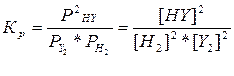 ,
,
Б) MgO(к) + CO2(г) = MgCO3(к),  .
.
337. N2 (г) + 3H2 (г) = 2NH3 (г),
| Cисх. | х | у | |
| Сравн. |
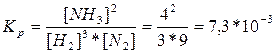 , Сисх. (N2) = [N2] + 0,5[NH3] = 3+ 0,5*4 = 5 моль/л.
, Сисх. (N2) = [N2] + 0,5[NH3] = 3+ 0,5*4 = 5 моль/л.
Сисх(Н2) = [Н2] + 1,5[NH3] = 9 + 1,5*4 = 15 моль/л.
338. CO + Cl2 = COCl2
| Cисх. | Х | у | |
| Сравн. | 0,2 | 0,3 | 1,2 |
 , Сисх. (Cl2) = [Cl2] + [COCl2] = 0,3 + 1,2 = 1,5 моль/л.
, Сисх. (Cl2) = [Cl2] + [COCl2] = 0,3 + 1,2 = 1,5 моль/л.
Сисх(CO) = [CO] + [COCl2] = 0,2 + 1,2 = 1,4 моль/л.
339. CO + H2O = CO2 + H2
| Cисх. | 0,03 | 0,03 | ||
| Сравн. | x | y | 0,01 | z |
Согласно уравнению реакции, водорода образуется столько же, сколько и СО2: [CO2]=[H2]=0,01 моль/л. СО и Н2О израсходовалось 0,01 моль/л, следовательно [CO]=[H2O]=0,02 моль/л. 
 .
.
340. FeO(k) + CO = Fe(k) + CO2
| Cисх. | - | 0,05 | - | 0,01 |
| Сравн. | - | 0,05-x | - | 0,01+x |
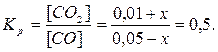 0,01+x=0,025-0,5x, x=0,01. [CO] = 0,05 - 0,01 = 0,04 моль/л. [CO2] = 0,01 + 0,01 = 0,02 моль/л.
0,01+x=0,025-0,5x, x=0,01. [CO] = 0,05 - 0,01 = 0,04 моль/л. [CO2] = 0,01 + 0,01 = 0,02 моль/л.
341. Br2 (г) + H2 (г) = 2HBr (г),
| Cисх. | |||
| Сравн. | 3-x | 1-x | 2x |
 , 3x2 + 4x - 3 = 0, x = 0,54.
, 3x2 + 4x - 3 = 0, x = 0,54.
[H2] = 3-0.54 = 2.46 моль/л, [Br2] = 1-0.54 = 0.46 моль/л, [HBr] = 2*0.54=1.08 моль/л.
w(H2)=(2.46/4)*100 %=61.5%, w(Br2)=(0.46/4)*100%=11.5%, w(HBr)=(1.08/4)*100%=27%.
342. N2O4 (г) = 2NO2 (г),
| Cисх. | 0.08 | |
| Сравн. | 50% | X |
Прореагировало 0.08*0.5 = 0.04 моль/л N2O4. Следовательно, образовалось 2*0.04 = 0.08 моль/л NO2 .
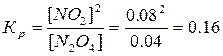 .
.
343. Y2 (г) + H2 (г) = 2HY (г),
| Cисх. | 0.01 | 0.01 | |
| Сравн. | 0.01-x | 0.01-x | 2x |
К=40
 х = 0.0076, [HY]=2*0.0076=0.015моль/л.
х = 0.0076, [HY]=2*0.0076=0.015моль/л.
В=(0.015*100)/(2*0.01)=76%
344. Y2 (г) + H2 (г) = 2HY (г),
| Cисх. | |||
| Сравн. | 1-x | 2-x | 2x |
К=50
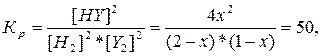 46х2 -150х + 100=0, х = 0.57, Теоретически может образоваться 2 моль HY, образовалось 0.57*2 = 1.14 моль. В=(1.14*100%) / 2 = 57 %.
46х2 -150х + 100=0, х = 0.57, Теоретически может образоваться 2 моль HY, образовалось 0.57*2 = 1.14 моль. В=(1.14*100%) / 2 = 57 %.
345. 2HY (г) = Y2 (г) + H2 (г)
| Cисх. | |||
| Сравн. | 1-2x | x | x |
К = 2*10-2
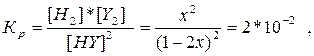 х = 0.11, разложилось 2*0.11 = 0.22моль HY, степень разложения 22 %.
х = 0.11, разложилось 2*0.11 = 0.22моль HY, степень разложения 22 %.
346. Cl2 (г) = 2Cl(г)
| Cисх. | 0.04 | |
| Сравн. | 0.04-x | 2x |
К=4.2*10-4
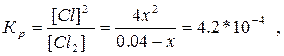 4х2 + 4.2*10-4х -1.68*10-5 = 0, х = 0.002, степень атомизации хлора равна (002/0.04)*100 % = 5 %.
4х2 + 4.2*10-4х -1.68*10-5 = 0, х = 0.002, степень атомизации хлора равна (002/0.04)*100 % = 5 %.
347. CO + H2O = CO2 + H2
| Cисх. | ||||
| Сравн. | 1-x | 1-х | х | х |
К=1. 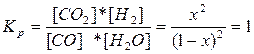 , х = 0.5, [CO2]=[H2]=0,5 моль/л, [CO]=[H2O]=0,5 моль/л.
, х = 0.5, [CO2]=[H2]=0,5 моль/л, [CO]=[H2O]=0,5 моль/л.
348. PCl5 = PCl3 + Cl2
| Cисх. | 0.3 | ||
| Сравн. | 0.3-x | х | х |
К=125. 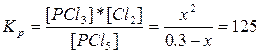 , х2 + 125х - 37.5 = 0, х = 0.299. Разложилось PCl5: (0.299/0.3)*100% = 99.76 %.
, х2 + 125х - 37.5 = 0, х = 0.299. Разложилось PCl5: (0.299/0.3)*100% = 99.76 %.
349. Принцип Ле Шателье: при оказании внешнего воздействия на реакцию, находящуюся в состоянии равновесия, ее равновесие смещается к состоянию, уменьшающему это воздействие. А) 2CO (г) + О2(г) = 2СО2 (г), ΔН0= -566 кДж/моль. Т.к. реакция экзотермическая, то при понижении температуры ее равновесие сместится вправо; т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при повышении давления равновесие сместится вправо. Б) N2 (г) + O2 (г) = 2NO (г), ΔН0= 180 кДж/моль. Т.к. реакция эндотермическая, то при понижении температуры ее равновесие сместится влево; т.к. количество газообразных продуктов реакции равно количеству газообразных исходных веществ, то повышение давления на равновесие не влияет.
350. При оказании внешнего воздействия на систему, находящуюся в состоянии равновесия, положение равновесия смещается к состоянию, уменьшающему это воздействие. А) 2H2 (г) + O2 (г) = 2H2O (г), ΔН0 = - 483.6 кДж/моль. Т.к. реакция экзотермическая, то при повышении температуры ее равновесие сместится влево; т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при понижении давления равновесие сместится вправо. Б) CaCO3 (k) = CaO (k) + CO2(г), ΔН0 = 179,0 кДж/моль. Т.к. реакция эндотермическая, то при повышении температуры ее равновесие сместится вправо; т.к. газообразные вещества - продукты реакции CO2 , то понижение давления сместит равновесие вправо.
351. N2 (г) + 3H2 (г) = 2NH3 (г), ΔH0= -92.4 кДж/моль. а) реакция экзотермическая, поэтому при увеличении температуры равновесие сместится влево, а при понижении - вправо. Б) Т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при повышении давления равновесие сместится вправо, а при понижении давления - влево. В) равновесие сместится вправо при повышении концентрации азота и водорода и понижении концентрации аммиака, при повышении концентрации аммиака и понижении концентрации азота и водорода равновесии сместится влево. Г) введение промоторов не смещает положение равновесия. д) Поглощение аммиака сместит равновесие вправо, а поглощение азота и водорода - влево. Е) введение инертного газа аналогично повышению давления.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 796; Нарушение авторских прав?; Мы поможем в написании вашей работы!