
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства алканов
|
|
|
|
Физические свойства.
Связи углерод-углерод и углерод-водород неполярны и, следовательно, единственными силами, притягивающими молекулы друг к другу, являются слабые вандерваальсовы силы. В результате углеводороды имеют низкие температуры кипения и плавления по сравнению со многими другими соединениями, имеющими аналогичную молекулярную массу. Углеводороды следуют общему эмпирическому правилу ”подобное растворяет подобное” и растворимы в неполярных растворителях и нерастворимы в полярных, таких как вода.
Алканы содержат только неполярные s- связи, что обусловливает их малую реакционную способность. Они не взаимодействуют при обычных условиях с концентрированными растворами кислот и щелочей, на них не действует в темноте бром, они не обесцвечивают раствор перманганата калия. Прочность s - связи и ее неполярность делают алканы очень устойчивыми в химическом отношении. Все реакции алканов протекают в достаточно жестких условиях (крекинг, сгорание) либо требуют участия очень реакционно-способных частиц, радикалов. Для алканов характерны реакции, протекающие с гомолитическим разрывом связи, т.е. радикальные реакции, а точнее, радикальное замещение (SR), где агентом реакции является свободный радикал. Радикал - частица, имеющая неспаренный электрон (Cl., СH3., NO2 .), либо молекула с двумя электронами, имеющими параллельные спины (молекула кислорода). Cвободные радикалы возникают при гомолитическом разрыве связи, при этом заряженных частиц не образуется. При гомолитическом расщеплении связи всегда затрачивается энергия. Эта энергия может приобретаться различными способами. Одним из способов расщепления s- связи является использование тепловой энергии (термолиз). При t=500о большинство органических реакций протекает по радикальному механизму (пиролиз, крекинг-процесс), поскольку при таких процессах энергии достаточно для разрыва большинства связей. Есть вещества, для которых энергия расщепления, энергия диссоциации связи настолько мала, что уже при низких температурах происходит ее диссоциация. Так, в бензольном растворе до 1,5% гексафенилэтана диссоциировано на трифенилметильные радикалы. Такие легко образующиеся радикалы называются стабильными. Другой способ разрыва s - связи - это ее расщепление при помощи лучистой энергии (фотолиз, радиолиз). Ультрафиолетовое облучение расщепляет большинство связей и приводит к образованию свободных радикалов. Последние могут быть получены и при окислительно-восстановительной реакции в водном растворе, например:
|
|
|
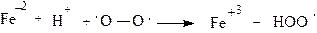 |
Такие процессы могут протекать и в организме и быть причиной многих патологических процессов. Как уже было сказано, свободные радикалы - это короткоживущие, реакционные частицы, имеющие неспаренный электрон. Стабильность радикала зависит от природы элемента, в первую очередь от его электроотрицательности, от характера заместителей в нем. Радикал тем устойчивее, чем меньше электроотрицательность атома, из которого он образован, например:
 |
Любые заместители, обладающие + I и + M эффектами, повышают устойчивость свободного радикала, например:
(CH3) 3 C - > (CH3)2CH - > CH3CH2 - > CH3 -
Особенно сильно повышают устойчивость радикалов заместители, проявляющие + М эффект. Поэтому наиболее устойчивы радикалы аллильного и бензильного типа:
C6H5-CH2 .> CH2=CH-CH2 .> (CH3)3C. > CH3-CH2- > CH3.> CH2=CH. > C6H5.
Предельные углеводороды вступают в реакции галогенирования и окисления. В этих реакциях затрагиваются преимущественно С-Н связи. Если радикал обладает достаточно высокой реакционной способностью, то он легко вступает в реакции замещения. Перенос радикальных свойств на другие молекулы может часто повторяться в определенной циклической последовательности, иными словами, носит цепной свободнорадикальный характер и называется реакцией радикального замещения.(SR). Алканы реагируют с галогенами (за исключением иода), образуя смеси галогеналканов. Например, при взаимодействии хлора с алканом атомы водорода углеводорода постепенно замещаются на атомы хлора, и, чем выше концентрация хлора, тем больше содержание полихлорированных углеводородов в смеси.
|
|
|
Реакция хлорирования метана до монохлорпроизводного описывается следующей схемой:
CH4 + Cl2 ® CH3Cl + HCl
Однако это уравнение отражает лишь суммарный итог процесса, который протекает через несколько элементарных стадий. Реакцию хлорирования проводят либо при нагревании (2500), либо при облучении ультрафиолетовым светом. В этих условиях связь в молекуле хлора разрывается гомолитически с образованием радикала хлора. Эта стадия называется стадией инициирования цепи.
1.Инициирование, возникновение свободного радикала:
h l
 |
Радикал хлора является очень активной частицей, которая атакует молекулу метана с образованием HCl и радикала CH3.. Метильный радикал реагирует с новой молекулой хлора, при этом образуется метанхлорид и новый радикал хлора, который может начать новый цикл таких же реакций. Эта стадия носит название стадии роста цепи.
2.Рост цепи:
Cl.+ CH4 ®CH3. + HCl
CH3. + Cl2® CH3Cl + Cl. и т.д.
Реакция заканчивается стадией обрыва цепи в результате столкновений свободных радикалов. Это может произойти несколькими способами:
3.Обрыв цепи:
 |
В общем случае, радикальные реакции осуществляются только тогда, когда они экзотермичны. Так как реакции проходят через несколько элементарных стадий, то некоторые стадии реакций могут быть и эндотермичны, но общий суммарный тепловой эффект реакции должен быть положителен. Тепловой эффект реакции определяется по закону Гесса как разность энергий расщепляющейся (энергия диссоциации) и образующейся связи. Реакционная способность радикала относительно данного субстрата тем выше, чем больше энергии выделяется при образовании новой связи, т.е. чем больше энергия диссоциации этой связи. При галогенировании алканов образуются смеси продуктов галогенирования. В алкане радикальной атаке подвергаются, в первую очередь, третичные, затем вторичные, а потом уже первичные связи. Это связано с разницей в энергиях диссоциации этих связей, которая составляет, соответственно, 381, 393.5 и 406 кдж/моль. Поэтому преимущественно получаются продукты галогенирования по третичному атому, потом - по вторичному, а затем уже по первичному атому углерода. Из галогенов, которые используются для получения галогенпроизводных, это хлор и бром. Радикал фтор обладает настолько высокой энергией, что реакция с фтором протекает с взрывом и не находит применения. Иод легко образует радикал, но реакция иодирования является эндотермической, т.е. иодирование в радикальных условиях осуществить не удается, другими словами, иод - ингибитор цепных реакций. Радикал хлор обладает настолько высокой энергией, что атакует любую C-H связь (первичную, вторичную или третичную), что приводит к получению смеси продуктов хлорирования. В отличие от хлора, радикал бром менее активен, и при бромировании атакуются исключительно третичные связи. Так, при радикальном бромировании 2-метилпропана получается исключительно трет.бромистый бутил.
|
|
|
 |
Реакции 2-метилпропана с хлором и бромом
Другой важной радикальной реакцией углеводородов является реакция окисления кислородом (реакция аутоокисления). Кислород, будучи радикальной молекулой, может реагировать по радикальному механизму, атакуя С-Н связи углеводорода. В первую очередь, кислород атакует третичный атом углерода, при этом образуются гидропероксиды. Для инициирования радикальных реакций часто используют вещества, которые легко образуют свободные радикалы. К таким веществам относятся алкил - и ацилпероксиды, энергия диссоциации связи в которых незначительна и при небольшом нагревании они легко распадаются на радикалы, например:
 |
|
|
|
Такие вещества называют промоторами цепных реакций. Есть вещества, которые способны, наоборот, останавливать цепные реакции. Это ингибиторы. К ним относятся иод, фенол, гидрохинон и др. При взаимодействии этих веществ с радикалом происходит передача радикальных свойств, но вновь образованные радикалы обладают малой реакционной способностью из-за большой делокализации неспаренного электрона.
В заключение надо отметить, что радикалы могут образовываться в живом организме и быть причиной многих патологических процессов, поэтому выяснение механизма радикальных реакций является предметом изучения медицины и биологии. К таким проблемам относится изучение воздействия облучения на живой организм, измерение концентрации свободных радикалов и сопоставление ее с канцерогенной активностью некоторых органических веществ, пероксидное окисление липидов, некоторые ферментативные реакции, и, наконец, проблема фотосинтеза.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1177; Нарушение авторских прав?; Мы поможем в написании вашей работы!