
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции замещения ОН - группы спиртов
|
|
|
|
Гидроксильная группа спиртов может быть замещена на галоген с образованием галогенпроизводных (1,3) или на алкоксильную группу с образованием простых эфиров(2):
 |
Механизмы реакций нуклеофильного замещения.
Указанные выше реакции протекают по механизму реакции нуклеофильного замещения. Реакции нуклеофильного замещения характерны для спиртов, галогенпроизводных, тиолов и аминов алифатического ряда, в которых sp3- гибридизованный атом углерода связан σ – связью с гетероатомом функциональной группы. Во всех этих соединениях за счет полярности связи С sp3 -> X на атоме углерода появляется + d заряд, который подвергается атаке нуклеофилом. Образование новой связи C-Y происходит за счет пары электронов нуклеофильного агента. Такому условию удовлетворяют как анионы, так и нейтральные молекулы, имеющие неподеленную пару электронов у гетероатома (вода,спирты,аммиак,амины и др.)
Общая схема реакции нуклеофильного замещения:
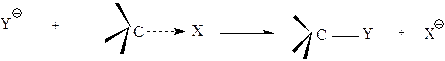 |
нуклеофил Субстрат продукт уходящая группа
реакции
Нуклеофильное замещение протекает по двум основным механизмам: мономолекулярному(S N 1) и бимолекулярному(SN2).
При мономолекулярном механизме реакция идет постадийно: сначала происходит медленная ионизация связи углерод -гетероатом в субстрате до диссоциации этой связи с образованием карбкатиона. Последний подвергается быстрой атаке нуклеофила. Рассмотрим конкретный пример SN1 реакции на примере получения трет-бутилбромида из трет-бутилового спирта. Трет-бутиловый спирт быстро реагирует с концентрированной бромистоводородной кислотой, образуя трет-бутилбромид по схеме:
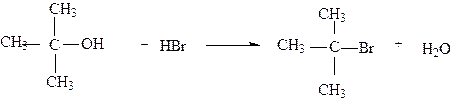
Первой стадией реакции является протонирование спирта кислотой, Это кислотно-основная реакция,в которой спирт выступает в качестве основания.
|
|
|
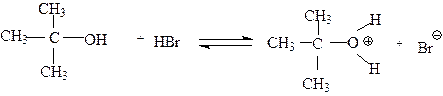 |
На следующей стадии в протонированном трет-бутиловом спирте происходит разрыв связи углерод-кислород вследствие ионизации. Оксониевый кислород оттягивает на себя пару электронов этой связи, в результате чего образуется достаточно устойчивый трет-бутилкатион и вода. Это медленная стадия реакции.
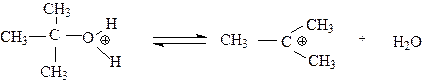 |
медленно
трет.бутил.катион
На последней стадии реакции анион брома атакует трет-бутил-катион с образованием трет-бутилбромида. На этой стадии бром-анион является нуклеофилом, поскольку он отдает пару электронов атому углерода.
 |
быстро
В ходе последней стадии атом, несущий положительный заряд, претерпевает изменение гибридизации. В катионе атом углерода находился в состоянии sp2 - гибридизации, в конечном продукте - в состоянии sp3- гибридизации. Теперь можно составить полную схему этой реакции
Механизм:
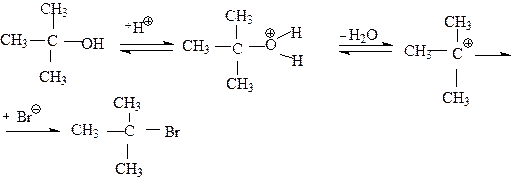
Скорость реакции SN1 v = k | субстрат| определяется самой медленной стадией, в которой участвует одно соединение (в вышерассмотренной реакции субстратом был трет-бутиловый спирт), изменение концентрации нуклеофильного агента практически не сказывается на суммарной скорости мономолекулярного замещения SN1. Как уже было сказано выше, лимитирующей стадией в реакции SN1 является образование карбкатиона. Устойчивость последнего и будет определять направление реакции. На стабильность любой частицы, в том числе и карбкатиона, влияют электронные и стерические факторы. Карбкатион тем устойчивее, чем больше находится при нем заместителей, обладающих + I эффектом, в этом же направлении работают стерические факторы (переход от гибридизации sp3 исходного состояния к sp2гибридизации в карбкатионе). Еще большее влияние на устойчивость карбкатиона оказывает +М эффект заместителей, поэтому бензил-катион - и аллил-катион являются еще более устойчивыми частицами по сравнению с алкил-катионами. Стабильность бензил- и аллилкатионов объяснется возможностью стабилизации их за счет делокализации положительного заряда на карбкатионе взаимодействием с соседней p-системой:
|
|
|
C6H5CH2+ > CH2= C H - CH2+ > (CH3)3C+ > (CH3) 2CH+ > CH3CH2+ > CH3+
Для определения конечного продукта реакции нуклеофильного замещения важное значение имеет знание стереохимического аспекта реакции. Геометрия промежуточного соединения – карбкатиона - такова, что атом углерода имеет плоское строение (sp2-гибридизация) и скорость взаимодействия такого катиона с нуклеофилом не зависит от того, с какой стороны плоскости происходит атака. Следовательно, в результате реакции образуется эквимолекулярная смесь энантиомеров, а исходное оптически активное соединение, подвергаясь реакции SN1, должно давать рацемический продукт. Одним из характерных примеров образования рацемата из оптически активного исходного соединения является реакция
(+) 3-метил-3-октанола с бромистоводородной кислотой с образованием (+-) 3-бром-3-метилоктанола:

3-метил-3-октанол 3-бром-3-метилоктан
Реакция SN2 характерна для первичных субстратов, скорость реакции v= k| Nu| |субстрат| пропорциональна концентрации обоих веществ (нуклеофила и субстрата). Рассмотрим реакцию взаимодействия этанола с бромистоводородной кислотой:
 C2H5- OH + HBr C2H5Br + H2O
C2H5- OH + HBr C2H5Br + H2O
В отличие от реакции SN1 эта реакция осуществляется синхронно с образованием переходного состояния, в котором атака нуклеофила и отщепление уходящей группы происходит одновременно без промежуточного образования карбкатиона. Входящий нуклеофил подходит к молекуле со стороны, противоположной уходящей группе. В переходном состоянии разрыв связи С-Х происходит по мере образования новой связи. Этот процесс можно представить следующей схемой:

переходное состояние
Нуклеофильный агент подходит к реагирующей молекуле с тыла, и, если реакционный центр в субстрате содержит хиральный атом углерода, то реакция происходит с обращением конфигурации, т.е. если молекула была оптически активна, то продукт реакции также оптически активен, но конфигурация хирального центра изменилась на противоположную. Тенденция субстрата вступать в реакции SN2 зависит от природы субстрата и силы нуклеофила. Обсудим оба эти фактора. Нуклеофил атакует наиболее электроположительный участок поляризованной ковалентной связи субстрата. Поэтому реакционная способность уменьшается в ряду R= метил > вторичный>третичный алкил. В этой же последовательности уменьшается величина положительного заряда на атоме углерода, подвергающегося нуклеофильной атаке:
|
|
|
+δ>+δ’>+δ”>+δ’’’
CH3+d-X > CH3CH2 +d’-X > (CH3)2 CH+d’’-X > (CH3)3C+d”’X
Эта закономерность объясняется влиянием электронных эффектов заместителей. В том же направлении работают и стерические факторы, так как объемные заместители вокруг атома углерода затрудняют подход нуклеофила. На скорость реакции нуклеофильного замещения SN2 оказывает влияние сила нуклеофила. Чем больше электроотрицательность атакующего атома, тем легче он атакует положительный участок поляризованной связи углерод - уходящая группа. Поэтому анионы являются более сильными нуклеофилами, чем сопряженные им кислоты.
SH- > H-SH; RO- > R-OH; Cl - > H- Cl
При движении сверху вниз в группе периодической системы элементов размеры атомов увеличиваются. Например относительные размеры атомов галогенов изменяются в следующем порядке:I > Br >Cl >F. В протонном растворителе нуклеофильность аниона обычно тем больше, чем больше размер аниона. Поэтому нуклеофильность атома в группе периодической системы элементов повышается при движении сверху вниз.
Общий порядок реакционной способности нуклеофилов в протонных растворителях следующий:
HS-, RS-> I-> Br- > RO-> Cl- > CH3CОO-> NO2- О-
меркаптид > иодид>бромид>алкоксид>хлорид> ацетат> нитрат
В реакции нуклеофильного замещения фактически один нуклеофил (атакующая частица) заменяет другой, называемый уходящей группой. Наилучшие уходящие группы обычно являются слабыми основаниями. Плохие уходящие группы - сильные основания. К их числу относятся, например, OH-, NH2-, RO-,CH3-, H- и др
|
|
|
Гидроксид-ион является более сильным основанием, чем вода; последняя является лучшей уходящей группой, чем гидроксид-ион. Наилучшие уходящие группы- сульфонаты, производные серной кислоты, обладают слабыми основными свойствами.
Многие процессы замещения протекают в живых организмах. В то время, как в лабораторных условиях в качестве уходящих групп используют галогениды и производные серной кислоты, в организме человека реакции замещения протекают с другими уходящими группами. Среди наиболее часто встречающихся в живых организмах уходящих групп - фосфатная группа
 |
- ОР(О)(OH)2. Например, гидролиз эфира фосфорной кислоты:
Подводя итоги рассмотрения механизмов реакции нуклеофильного замещения, можно сделать следующие выводы. Первичные соединения алифатического ряда реагируют преимущественно по SN2 механизму, а третичные - по SN1 механизму. Вторичные соединения могут реагировать по любому механизму в зависимости от природы нуклеофила, уходящей группы и растворителя. Высокая концентрация сильного нуклеофила способствует SN2 -механизму, а полярный растворитель - механизму SN1, поскольку сольватация стабилизирует промежуточные карбкатионы.
Все рассуждения о механизмах реакций нуклеофильного замещения касались соединений с атомом углерода в sp3- гибридизации.
Арильные и винильные соединения вступают в реакции нуклеофильного замещения в очень жестких условиях.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 6172; Нарушение авторских прав?; Мы поможем в написании вашей работы!