
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства карбонильных соединений
|
|
|
|
Поляризация карбонильной группы обусловливает наличие диполь-дипольного притяжения между молекулами. Эти силы должны быть преодолены прежде, чем соединения смогут испаряться, так что карбонильные соединения имеют более высокие температуры кипения, чем углеводороды сравнимой молекулярной массы.
Таблица
| Соединение | Молекулярная масса | Т.кип.0С |
| Пентан | ||
| Бутаналь | ||
| Бутанон |
Однако температуры кипения альдегидов и кетонов значительно ниже, чем соответствующих спиртов. В целом температура кипения кетонов несколько выше, чем изомерных им альдегидов. Низшие альдегиды и кетоны хорошо растворимы в воде, иногда, правда, с ней взаимодействуя. Раствор формальдегида в воде называется формалином и широко используется как дезинфицирующее средство. Низшие альдегиды имеют резкий запах, высшие альдегиды обладают цветочными запахами.
Химические свойства.
Карбонильные соединения являются одними из наиболее активных органических соединений, широко используемых в органическом синтезе. Карбонильная группа определяет основную группу реакций, характерных для этого класса соединений. Вследствие различия в электроотрицательности атомов углерода и кислорода p - связь между ними сильно поляризована, в результате чего на атоме углерода карбонильной группы возникает эффективный положительный заряд (+d) заряд, а на атоме кислорода -отрицательный (-d). Атом углерода, таким образом, является удобным центром для нуклеофильной атаки. Реакции нуклеофильного присоединения (АN.) являются наиболее характерными для карбонильных соединений. Этому способствует кислый катализ, поскольку протонируется атом кислорода карбонильной группы, вследствие чего на атоме углерода возникает полный положительный заряд. Кислотный катализ используется в тех случаях, когда нуклеофилы обладают низкой активностью. В качестве нуклеофилов, которые присоединяются к карбонильной группе, можно назвать очень различные агенты, например: вода, спирт, амины, гидроксиламин, гидразин, производные гидразинов, синильная кислота (при щелочном катализе), гидриды металлов, металлоорганические соединения. Скорость реакции нуклеофильного присоединения зависит как от нуклеофильности агента, так и от величины положительного заряда на карбонильной группе соответствующего карбонильного соединения. Учитывая влияние электронных и пространственных факторов групп, связанных с карбонильной группой, можно сказать, что альдегиды обладают большей реакционной способностью, чем кетоны, и, следовательно, способность подвергаться нуклеофильной атаке среди карбонильных соединений изменяется в следующей последовательности:
|
|
|
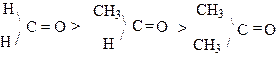 |
Ароматические карбонильные соединения обладают меньшей реакционной способностью, чем их алифатические аналоги, так как частичный положительный заряд на карбонильном атоме углерода может делокализоваться с участием бензольного ядра. Например бензальдегид менее химически активен, чем этаналь. Электронодонорные заместители в ароматическом кольце (например, ОН, NH2) вызывают дальнейшее уменьшение реакционной способности, а электроноакцепторные (например,NO2) _ ее увеличение.
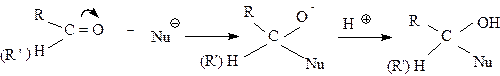 |
В общем виде схема реакции присоединения АN для карбонильных соединений может быть представлена следующим образом:
альдегид нуклеофил продукт
или присоединения кетон нуклеофила
Так как карбонильный атом углерода является плоским, то нуклеофильная атака равновероятна с обеих сторон плоскости, т.е. эта реакция нестереоселективна. По приведенной выше схеме осуществляются важные реакции карбонильных соединений. Обычно эти реакции являются каталитическими. Используется как кислотный, так и основной катализ. При кислотном катализе активируется карбонильный атом углерода,
|
|
|
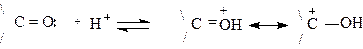 |
при основном - активируется нуклеофильный агент:
 |
Как видно, при кислотном катализе на карбонильном атоме углерода появляется целый положительный заряд, который легче подвергается атаке нуклеофильного агента. При основном катализе вместо нейтральной молекулы получается анион, который обладает значительно более сильной нуклеофильной силой. Приведем наиболее важные реакции нуклеофильного присоединения.
1.Присоединение воды.
Присоединение воды к карбонильным соединениям _ реакция обратимая. Степень гидратации зависит от строения субстрата. Однако продукты гидратации выделить не удается. 40%раствор формальдегида в воде называется формалином. Наличие электроноакцепторных заместителей стабилизируют продукт гидратации. Так, трихлоруксусный альдегид (хлораль) существует в виде гидрата. Также в виде гидрата существует нингидрин, реактив, используемый для обнаружения a- аминокислот.
2.Присоединение спиртов.
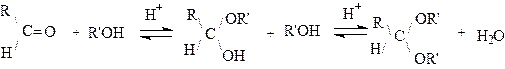 |
Спирты, как и вода, присоединяются к альдегидам и кетонам, но, в отличие от реакции гидратации, эта реакция является очень важной. Продукт присоединения одного моля спирта к альдегиду или кетону называется, соответственно, полуацеталями или полукеталями Aцетали и кетали образуются при взаимодействии полуацеталя (полукеталя) со второй молекулой спирта:
полуацеталь полный ацеталь
альдегида
Обычно полуацетали (соответственно полукетали) выделить невозможно, поскольку они легко отщепляют молекулу спирта, превращаясь в исходное карбонильное соединение. Однако, если гидроксильная и карбонильная группа находятся в одной молекуле, то могут образовываться циклические полуацетали и полукетали. Так, углеводы, являющиеся полигидроксильными карбонильными соединениями, обычно существуют в виде циклических полуацеталей(или полукеталей).
При стоянии альдегиды склонны к образованию циклических или полимерных ацеталей. Формальдегид дает твердый линейный полимер, параформ.
|
|
|
 n CH2O HO __ (CH2_ O) n _ H
n CH2O HO __ (CH2_ O) n _ H
Аналогично этаналь образует тример _ паральдегид.
Их следует рассматривать как циклические ацетали.
Ацетали и кетали нашли применение для защиты карбонильной группы.
С сернистыми аналогами спиртов альдегиды и кетоны образуют тиоацетали и тиокетали.
3.Присоединение циановодородной кислоты.
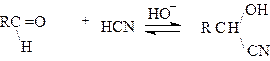 |
В присутствии щелочи альдегиды и кетоны присоединяют циановодород с образованием a_гидроксинитрилов или циангидринов. Схема реакции:
Циангидрины используются для синтеза a _гидроксикислот и a- аминокислот.
4.Присоединение гидридов металлов. Присоединение гидридов металлов, а также взаимодействие с магнийорганическими соединениями приводит к получению спиртов. Эта реакция восстановления. При взаимодействии гидрида металла с альдегидом образуется первичный спирт:
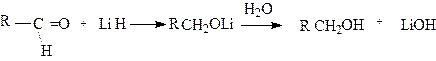 |
При действии гидрида металла на кетон получается вторичный спирт.
5.Присоединение аммиака, аминов, гидразина, гидроксиламина.
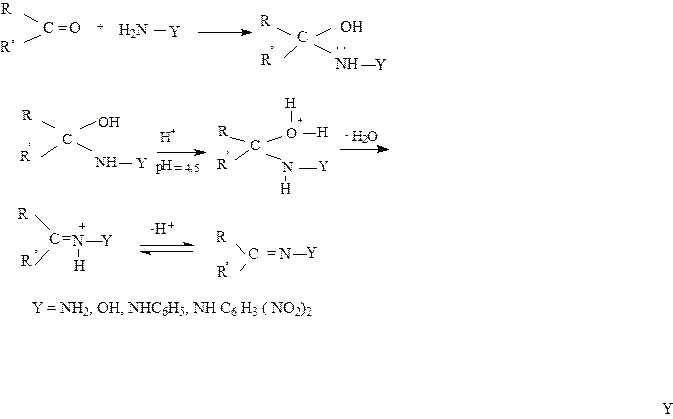 |
Присоединение этих агентов происходит по вышеуказанному механизму получения ацеталей. Но реакция не останавливается на стадии присоединения, а идет с отщеплением воды с образованием продукта конденсации. Механизм этой реакции:
Гидроксиламин Фенилгидразин 2,4-динитрофенилгидразин
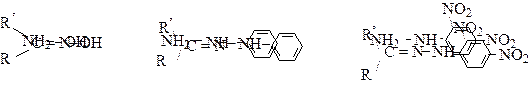 |
Оксим Фенилгидразон 2,4-динитрофенилгидразон
Структуры некоторых соединений, используемых для идентификации и характеристики карбонильных соединений.
Первичные амины присоединяются к альдегидам и кетонам с образованием в качестве промежуточных продуктов аминоспиртов, отщепление от которых молекулы воды приводит к образованию иминов, или оснований Шиффа.
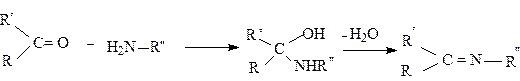 |
В настоящее время доказано, что имины образуются в качестве промежуточных соединений в ряде важных биохимических реакций, например, в реакции переаминирования. С другой стороны, многие азотсодержащие производные карбонильных соединений используются для идентификации и характеристики самих карбонильных соединений. Как правило, это хорошо кристаллизующиеся соединения с четкими температурами плавления, в отличие от самих карбонильных соединений, являющихся, как правило, жидкостями.
|
|
|
Другой важной реакцией, характерной для альдегидов и кетонов является кето - енольная таутомерия карбонильных соединений и связанные с ней превращения. В карбонильных соединениях атом водорода, соседний с карбонильной группой, обладает подвижностью, или кислотностью. Поэтому основания, например водная щелочь, может отщеплять протон a - углеродного атома с образованием аниона (атом углерода, соседний с функциональной группой, называется a - углеродным атомом). Легкость отщепления протона объясняется двумя причинами. Первая - отрицательный индуктивный эффект карбонильной группы вызывает смещение электронной плотности от связи С-Н, что способствует отрыву протона под действием основания.
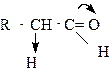 |
Вторая причина - основная. Образующийся анион может быть стабилизирован за счет сопряжения образовавшегося отрицательного заряда на атоме углерода с p - связью карбонильной группы. В результате этого взаимодействия происходит рассредоточение отрицательного заряда более, чем по одному атому, включая электроотрицательный атом кислорода. Такой мезомерный анион значительно более устойчив, а значит, скорее образуется, чем анион, в котором отрицательный заряд локализован на одном атоме:
 |
мезомерный -ион
Образовавшийся таким образом анион может протонироваться по двум положениям с образованием двух изомерных соединений, называемых кетонной и енольной формами, каждая из которых при потере протона возвращается к общему ”енолят - аниону “.
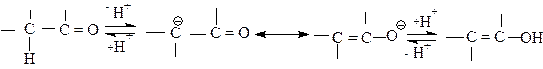 |
кето-форма мезомерный енолят –ион енольная форма
Итак, оказывается, что любой альдегид или кетон, имеющий атомы водорода в a - положении по отношению к карбонильной группе, будет находиться в равновесии со своей енольной формой, и взаимопревращение осуществляется через енолят-анион, содержащийся в низкой концентрации. Для получения высоких концентраций енолят-иона необходимо применение сильных оснований (например, этоксид-иона,C2H5O-), но практически даже слабые основания, такие как щелочная поверхность стекла, катализирует взаимопревращение кетонной и енольной форм. Таким образом, любой обычный кетон или альдегид будет содержать в незначительной степени енол (если возможна енолизация). Для простых альдегидов или кетонов содержание енола обычно очень мало (например, для ацетона составляет 10-4 %), но для некоторых карбонильных соединений оно может быть значительным. Так, для ацетилацетона содержание енольной формы достигает 70%, а фенол является и вовсе 100% енолом. Енол и соответствующее карбонильное соединение являются структурными изомерами, легко переходящими друг в друга. Такие изомеры называются таутомерами. Явление таутомерии наиболее характерно для соединений, содержащих “подвижный водород”. Таутомерия характерна не только для карбонильных соединений. Таутомеры, в отличие от резонансных структур, - это различные соединения, которые могут обычно легко превращаться друг в друга, но их можно выделить в индивидуальном виде. Енолят- ионы являются нуклеофилами и могут выступать в качестве промежуточных соединений в ряде реакций. Так, в присутствии оснований большинство альдегидов и кетонов вступают в реакцию конденсации. Реакциями конденсации называют реакции, которые приводят к образованию углерод - углеродных связей. Эта реакция называется реакцией альдольной конденсации, если она идет без выделения простых молекул (воды,аммиака).
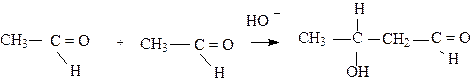 |
Механизм этой реакции предполагает образование енолят-иона, который, действуя как нуклеофил, атакует карбонильную группу другой молекулы карбонильного соединения.
3-гидроксибутаналь
Реакции альдольного присоединения имеют место в биохимических реакциях, в частности, в углеводном обмене веществ.
В лабораторных условиях провести альдольную кондесацию между двумя разными карбонильными соединениями с удовлетворительным выходом нельзя. Трудности возникают из-за того, что могут получиться четыре возможных продукта. Однако”смешанные” конденсации можно осуществить, если одно из карбонильных соединений не имеет a - водородных атомов (например, формальдегид, бензальдегид). В альдольной конденсации, как уже было сказано, образуется b-гидроксикарбонильное соединение, которое в условиях реакции может отщеплять воду с образованием α, β - ненасыщенного альдегида или кетона. Особенно это легко происходит, когда двойная связь сопряжена с карбонильной группой, например:
 |
Конденсация последнего типа называется кротоновой конденсацией.
Окисление альдегидов и кетонов.
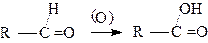 |
Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов. Они окисляются даже кислородом воздуха.
Качественной реакцией на альдегидную группу является реакция с аммиачным раствором гидроксида серебра, «реакция серебряного зеркала”:
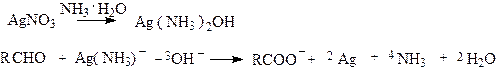 |
Кетоны не окисляются ни кислородом воздуха, ни аммиачным раствором гидроксида серебра. Они окисляются лишь под действием более сильных окислителей, таких как перманганат калия. При окислении кетон расщепляется с образованием кислот с меньшим числом углеродных атомов, причем разрыв цепи происходит рядом с карбонильным атомом углерода, например:
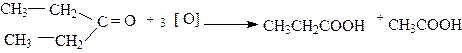 |
пропионовая уксусная
кислоты
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 2236; Нарушение авторских прав?; Мы поможем в написании вашей работы!