
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экзаменационный билет № 4. Основной постулат химической кинетики
|
|
|
|
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3
Основной постулат химической кинетики
1867 г. Гульдберг, Вааге – закон действующих масс:
скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов
aA + bB → сС + dD
V=k[A]a[B]b
1. Понятие о дисперсных системах. Дисперсная фаза, дисперсионная среда. Классификации и примеры дисперсных систем.
2. Защитные покрытия металлов от коррозии. Анодные и катодные покрытия.
Ответ:
Дисперсными называют такие системы, в которых одно или несколько веществ в виде мелких частиц распределены в другом веществе.
При этом распределяемое вещество принято называть дисперсной фазой, а вещество, в котором происходит распределение, - дисперсной средой.
| Дисперсные системы | Размеры частиц дисперсной системы | Устойчивость и гомогенность системы |
| Грубодисперсные (суспензии, взвеси) | 10-3…10-5 см (10…0,1 мкм) | Неустойчивы, гетерогенны |
| Тонкодисперсные (коллоидные растворы) | 10-5…10-7 см (0,1…0,001 мкм) | Довольно устойчивы, микрогетерогенны |
| Молекулярно-дисперсные (истинные растворы) | ~10-8 см (размер молекул и ионов) | Весьма устойчивы, гомогенны |
| Дисперсная среда | Дисперсная фаза | Примеры |
| Газ | газ жидкость твердое тело | газовые смеси (воздух) туманы, облака пыль, дым |
| Жидкость | газ жидкость твердое тело | пена эмульсии (молоко, кремы, мази), суспензии, взвеси (глина в воде) |
| Твердое тело | газ жидкость твердое тело | твердые пены(пенопласты, пемза, пеностекло) твердые эмульсии (вода в парафине, жемчуг) сплавы, твердые растворы |
Защитные покрытия:
Металлические
Химические
Неметаллические
|
|
|
- Неорганические (эмали)
- Органические (лаки, краски, пластмассы, смолы, битум, асфальт)
Анодное покрытие – покрытие металлом, с более отрицательным потенциалом
Оцинкованное железо
А(–) Zn – 2e– → Zn2+
K(+) (Fe) 2H+ + 2e– → H2
Катодное покрытие – покрытие металлом, с более положительным потенциалом
Луженое железо
А(–) Fe – 2e– → Fe2+
K(+) (Sn) 2H+ + 2e– → H2
1. Основные положения квантовой механики: уравнение де Бройля, принцип неопределенности Гейзенберга, уравнение Шредингера.
2. Свойства разбавленных растворов неэлектролитов (законы Рауля).
Ответ:
В 20-х годах XX столетия было установлено, что любая частица имеет корпускулярно-волновую природу. Согласно теории Л. де Бройля (1924 г.), каждой частице с импульсом соответствует волновой процесс с длиной волны λ, т.е. λ = h / p. Чем меньше масса частицы, тем больше длина волны. Для элементарных частиц В. Гейзенберг сформулировал принцип неопределенности, согласно которому невозможно одновременно определить положение частицы в пространстве и ее импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме. В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь (АО) – область атомного пространства, в котором вероятность нахождения электрона наибольшая. Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера. Пусть волновая функция задана в N-мерном пространстве, тогда в каждой точке с координатами 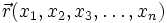 , в определенный момент времени t она будет иметь вид
, в определенный момент времени t она будет иметь вид 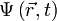 . В таком случае уравнение Шрёдингера запишется в виде:
. В таком случае уравнение Шрёдингера запишется в виде:
|
|
|
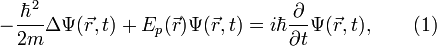
где 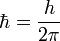 ,
, 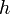 — постоянная Планка;
— постоянная Планка; 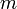 — масса частицы,
— масса частицы, 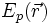 — внешняя по отношению к частице потенциальная энергия в точке
— внешняя по отношению к частице потенциальная энергия в точке 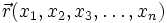 ,
, 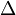 — оператор Лапласа (или лапласиан), эквивалентен квадрату оператора набла.
— оператор Лапласа (или лапласиан), эквивалентен квадрату оператора набла.
(Точное решение получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения). Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1153; Нарушение авторских прав?; Мы поможем в написании вашей работы!