
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Давление насыщенного пара растворителя
|
|
|
|
II. Давление пара разбавленных растворов. Закон Рауля
Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при одной и той же температуре. Согласно закону Рауля (I закон ), относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества:
 , где
, где
Þ 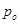 -давление пара над чистым растворителем, Па;
-давление пара над чистым растворителем, Па;  - давление пара растворителя над раствором нелетучего вещества, Па; /
- давление пара растворителя над раствором нелетучего вещества, Па; / 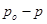 /– абсолютное понижение давления пара над раствором, Па. Величина
/– абсолютное понижение давления пара над раствором, Па. Величина  - относительное понижение давления пара над раствором.
- относительное понижение давления пара над раствором.
Þ 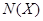 - молярная доля растворенного вещества (Х), которая определяется по формуле:
- молярная доля растворенного вещества (Х), которая определяется по формуле:  , где
, где  - число молей растворенного вещества;
- число молей растворенного вещества; 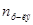 - число молей растворителя. Величина
- число молей растворителя. Величина  – мольная доля растворенного вещества.
– мольная доля растворенного вещества.
Þ Число молей растворенного вещества и растворителя можно находить по формулам:  или
или 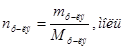 .
.
Þ Отсюда можно найти:  и
и 
Таким образом, относительное понижение давления пара растворителя над раствором (или депрессия раствора) зависит только от концентрации раствора, но не зависит от температуры. Для разбавленных растворов  по сравнению
по сравнению 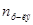 мало и поэтому его величиной в знаменателе уравнения:
мало и поэтому его величиной в знаменателе уравнения:  можно пренебречь и тогда закон Рауля примет вид:
можно пренебречь и тогда закон Рауля примет вид: 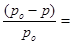
 .
.
Закон Рауля точно соблюдается только для идеальных растворов и приближенно для разбавленных реальных растворов: чем разбавленнее раствор, тем более он приближается к идеальному.
2.2. Температура кипения и замерзания растворителя и раствора (II закон Рауля)
Изучая кипение и замерзание растворов, Рауль (1882) установил, что повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов пропорционально моляльности растворов. Эта закономерность называется вторым законом Рауля и его математическим выражением являются уравнения:
|
|
|

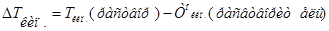
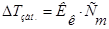

 - моляльность раствора;
- моляльность раствора;
 - эбуллиоскопическая постоянная растворителя (от лат. «ebbulire» — выкипать);
- эбуллиоскопическая постоянная растворителя (от лат. «ebbulire» — выкипать);
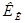 - криоскопическая постоянная растворителя (от греч. «криос» - холод);
- криоскопическая постоянная растворителя (от греч. «криос» - холод);
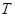 - температура кипения и замерзания раствора;
- температура кипения и замерзания раствора;
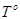 – температура кипения и замерзания чистого растворителя.
– температура кипения и замерзания чистого растворителя.
Постоянные константы  и
и 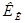 не зависят от природы растворенного вещества, а характеризуют лишь растворитель. Справочные значения констант
не зависят от природы растворенного вещества, а характеризуют лишь растворитель. Справочные значения констант  и
и 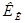 для некоторых растворителей приведены в таблице (см. приложение 6).
для некоторых растворителей приведены в таблице (см. приложение 6).
На измерениях температур кипения и замерзания основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ:


Второй закон Рауля иногда называют следствием первого. Ряд ученых подразделяют все закономерности, установленные Раулем на три закона:
1. тоноскопический (понижение давления пара над раствором);
2. криоскопический (понижение температуры замерзания раствора);
3. эбуллиоскопический (повышение температуры кипения раствора).
В целом, обобщенные формулы для разбавленных растворов электролитов и неэлектролитов имеют вид:
 Для растворов неэлектролитов Для растворов неэлектролитов
| Для растворов электролитов |
1. 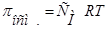 2.
2. 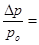  3.
3. 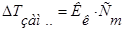 4.
4. 
| 1. 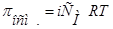 2.
2. 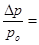  3.
3. 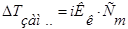 4.
4. 
|
Задача №1. Применение соединений цинка в медицине основано на том, что цинк дает соединения с белками – альбуминаты растворимые и нерастворимые, последние обычно образуют пленку на тканевой поверхности и оказывают подсушивающее действие, что способствуют заживлению тканей, а растворимые оказывают действие от слабовяжущего до резко прижигающего. Осмотическое давление 0,1 М. ZnSO4 при 0°С равно  Па. Определить кажущуюся степень диссоциации соли в данном растворе.
Па. Определить кажущуюся степень диссоциации соли в данном растворе.
|
|
|
Решение.
1. Для растворов электролитов применяем формулу: 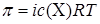 , из которой находим изотонический коэффициент:
, из которой находим изотонический коэффициент: 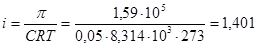 .
.
2. Соль 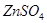 при диссоциации образует 2 иона (К=2).
при диссоциации образует 2 иона (К=2).
3. Согласно (3)  , отсюда
, отсюда 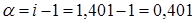 или
или  .
.
Ответ.  .
.
Задача №2. Определить концентрацию раствора глюкозы, если раствор этого вещества при 18°С изотоничен с раствором, содержащим 0,5 моль/л хлорида кальция. Кажущаяся степень диссоциации СаCI2 в растворе при указанной температуре составляет 65,4%.
Решение.
1. Согласно (1) и (2) 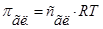 , а
, а  .
.
2. Так как оба раствора изотоничны, то  .
.
3. При диссоциации молекулы соли 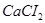 образуется 3 иона (К=3),
образуется 3 иона (К=3), 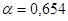 .
.
4. Согласно формуле (3): 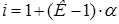
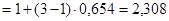 . Следовательно,
. Следовательно,  .
.
Ответ.  моль/л.
моль/л.
Задача № 3. В медицине раствор формальдегида применяется для консервации анатомических и биологических препаратов и не может быть назначен внутрь, т.к. является протоплазматическим ядом. Определить температуру кипения раствора, содержащего 6 г формальдегида  в 100 г воды.
в 100 г воды.  град∙кг/моль.
град∙кг/моль.
Решение.
1. Согласно закону эбулиоскопии(Рауля): 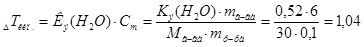 град.
град.
2. Тогда 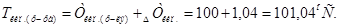
Ответ. 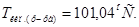
Задача №4. По фармакологическим свойствам этиловый спирт относится к веществам наркотического действия. Воздействуя на кору головного мозга, он вызывает характерное алкогольное возбуждение, в больших дозах – ослабление возбудительных процессов коры и угнетение деятельности дыхательного центра. При какой примерно температуре будет замерзать 40 % водный раствор 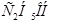 .
.
Решение.
1. Из формулы закона криоскопии (Рауля): 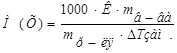 , следует:
, следует: 
2. Отсюда: 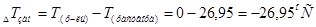 .
.
Ответ. Раствор начнет замерзать примерно при  .
.
1.2. Ситуационные задачи №№5, 6, 7,8 для закрепления материала (выполнить в протокольной тетради).
Задача №5. В медицинской практике для компенсации больших потерь крови больному вводят физиологический раствор. Рассчитайте массовую долю (в %) NaCI (с точностью до целых) в физиологическом растворе, осмотическое давление которого при 25оС составляет 762,7 кПа (α=1, ρ=1 г/см3).
Задача №6. С медицинской целью камфору применяют натуральную правовращающую, добываемую из камфорного дерева, либо синтетическую левовращающую, полученного из пихтового масла, либо рацемическую. Криоскопическая постоянная камфоры равна 40,27 оС. 0,0113 г фенантрена понизили точку замерзания 0,0961 г камфары на 27,0 оС. Найдите молярную массу фенантрена в камфоре.
|
|
|
Задача №7. В медицинской практике фруктозуприменяют при лечении белой горячки и американскими учеными предложено ее вводить в состав «отрезвляющих» препаратов, т.к. фруктоза, применяемая в дозе 1 г на кг массы тела одновременно с алкоголем, увеличивает скорость его выведения из организма на 10%, а принимаемая через час – на 20-30%.
Вычислите температуру кипения и замерзания 5% водного раствора фруктозы.  К∙кг/моль,
К∙кг/моль, 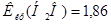 К∙кг/моль.
К∙кг/моль.
Задача №8. Бензол используется для синтеза поверхностно-активных веществ, в том числе большое количество фармацевтических препаратов. Вычислите давление насыщенного пара над раствором бензола (Mr=78 г/моль), в 83 г которого содержится 12,8 г нафталина - С10Н8 (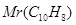 = 128 г/моль), если давлениенасыщенного пара бензола при 20оС равна 100 кПа.
= 128 г/моль), если давлениенасыщенного пара бензола при 20оС равна 100 кПа.
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 3650; Нарушение авторских прав?; Мы поможем в написании вашей работы!