
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
Обратимый и необратимый процессы
Данные полученные с осциллографа

Рис 1

Рис2

Рис3

Рис4 Управляющий сигнал открытие теристоров
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Реальные процессы необратимы, в них всегда происходит диссипация (потеря) энергии (из-за трения, теплопроводности и т.д.). Обратимые процессы – это физическая модель, идеализация реальных процессов.
Количество теплоты dQ, которое должно быть доставлено системе или отнято у нее при переходе из одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но в значительной степени зависит от способа осуществления этого перехода.
Однако приведенное количество теплоты – отношение теплоты dQ к температуре T системы при бесконечно малых изменениях состояния системы – это функция состояния системы. Докажем это.
Запишем первое начало термодинамики для одного моля идеального газа:
dQ = dU + dA или dQ = CmVdT + PdV.
Разделим почленно на абсолютную температуру T, выразим отношение  из уравнения Менделеева - Клапейрона:
из уравнения Менделеева - Клапейрона:  и получим
и получим
 .
.
Заметим, что  ;
;  , тогда можно записать:
, тогда можно записать:
 .
.
Правая часть последнего равенства является полным дифференциалом, следовательно,  также является полным дифференциалом некоторой функции, которую мы обозначим S, тогда
также является полным дифференциалом некоторой функции, которую мы обозначим S, тогда
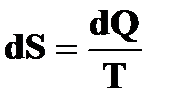 ,
,
где S — энтропия системы.
Энтропией S системы называется однозначная функция состояния, изменение которой равно количеству тепла, подводимому к системе обратимо, деленному на абсолютную температуру в момент подведения этого тепла:
|
|
|
 и
и  .
.
В определении существенным является обратимость процесса. Если тепло dQ сообщается системе в необратимом процессе, то энтропия растет как следствие сообщения тепла, так и из-за необратимости процесса. Поэтому в случае необратимого процесса  .
.
 ,
,
знак "=" относится к обратимым процессам, знак ">" — к необратимым.
В замкнутой системе для обратимых процессов  для необратимых процессов
для необратимых процессов 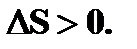
Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов):
 Поскольку dS и dQ имеют один и тот же знак, то по характеру изменения энтропии можно судить о направлении процесса теплообмена. При нагревании тела
Поскольку dS и dQ имеют один и тот же знак, то по характеру изменения энтропии можно судить о направлении процесса теплообмена. При нагревании тела  и его энтропия возрастает:
и его энтропия возрастает:  , при охлаждении
, при охлаждении  и энтропия тела убывает:
и энтропия тела убывает: 
Изоэнтропийным называется процесс, протекающий при постоянной энтропии (S = const).
В обратимом адиабатическом процессе  , так что
, так что  и S=const, поэтому адиабатический процесс является изоэнтропийным.
и S=const, поэтому адиабатический процесс является изоэнтропийным.
Свойства энтропии:
1. Энтропия является однозначной функцией состояния, поэтому изменение энтропии не зависит от вида процесса, а определяется начальным и конечным состоянием системы.
2. Энтропия определяется с точностью до произвольной постоянной. Действительно, соотношения  и
и 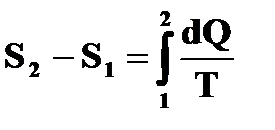 определяют изменение энтропии, а не саму эту функцию.
определяют изменение энтропии, а не саму эту функцию.
3. Энтропия обладает свойством аддитивности: энтропия системы из нескольких тел равна сумме энтропий каждого тела.
4. Энтропия системы при протекании в ней обратимого адиабатического процесса не изменяется. Действительно, при адиабатическом процессе dQ=0, тогда  =0 и S=const. Поэтому обратимые процессы, происходящие без обмена теплом, называются изоэнтропическими.
=0 и S=const. Поэтому обратимые процессы, происходящие без обмена теплом, называются изоэнтропическими.
|
|
|
5. Изменение энтропии при обратимом изотермическом процессе (Т=const):
 ,
,
где Q — сообщаемое системе тепло.
6. Изменение энтропии при обратимом изохорическом процессе (V=const):
 .
.
7. Изменение энтропии при обратимом изобарическом процессе (P=const):

|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 482; Нарушение авторских прав?; Мы поможем в написании вашей работы!