
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
БИОХИМИЯ 2 страница
|
|
|
|
На первой стадии молекулы реагирующих веществ (субстрата) присоединяются к адсорбционному участку активного центра фермента за счет слабых связей. Образуется фермент-субстратный комплекс, который может легко распадаться снова на фермент и субстрат, т. е. первая стадия ферментативного катализа полностью обратима. На этой стадии с помощью активного центра возникает благоприятная ориентация реагирующих молекул, что способствует их дальнейшему взаимодействию.
На второй стадии с участием каталитического участка активного центра и молекул субстрата происходят различные реакции, характеризующиеся низкой величиной энергии активации и поэтому протекающие с большой скоростью. В результате этих реакций в конечном счете образуется либо продукт реакции, либо почти готовый продукт.
На третьей стадии происходит отделение продукта реакции от активного центра с образованием свободного фермента, способного присоединять к себе новые молекулы субстрата. Если на второй стадии был получен почти готовый продукт, то он предварительно превращается в продукт, который затем отделяется от фермента.
| I стадия |
Схематично стадии ферментативного катализа можно представить следующим образом:
I стадия 11 стаДия
1.------------ а----
Е + S ES ^ГГ ES' Е + Р
Фермент Субстрат Фермент- Химически Продукт
субстратный преобразованный комплекс фермент-субстратный
комплекс (S' - продукт или почти готовый продукт)
В клетках ферменты, катализирующие многостадийные химические процессы, часто объединяются в комплексы, называемые мультифер- ментными системами. Эти комплексы структурно связаны с органоидами клеток или же встроены в биомембраны. Объединение отдельных ферментов в единый комплекс позволяет одновременно ускорять все последовательные стадии превращения какого-либо субстрата.
|
|
|
В некоторых случаях в катализе наряду с белком-ферментом еще участвует низкомолекулярное (небелковое) соединение, называемое коферментом. Большинство коферментов в своем составе содержат витамины. Строение и механизм действия коферментов будут рассмотрены при описании химических реакций, в которых они принимают участие.
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Различают два вида специфичности ферментов: специфичность действия и субстратную специфичность.
Специфичность действия - это способность фермента катализировать только строго определенный тип химической реакции. Если субстрат может вступать в разные реакции, то для каждой реакции нужен свой фермент. Например, широко распространенный в клетках глюко-
зо-6-фосфат (производное глюкозы) подвергается различным превра-
щениям:
 Глюкоза + фосфорная кислота
Глюкоза + фосфорная кислота
Гпюкозо-6-фосфат-------- Гпюкозо-1 -фосфат
 Фруктозо-6-фосфат
Фруктозо-6-фосфат
Отщепление от этого субстрата фосфорной кислоты происходит под действием фермента фосфатазы. При этом фосфатаза катализирует только реакцию отщепления фосфорной кислоты, никакие другие превращения глюкозо-6-фосфата этот фермент не ускоряет. Другое возможное превращение глюкозо-6-фосфата осуществляется с участием фермента мутазы. В этом случае глюкозо-6-фосфат переходит в глю- козо-1-фосфат. Еще один фермент - изомераза - вызывает превращение глюкозо-6-фосфата во фруктозо-6-фосфат.
Таким образом, каждый фермент катализирует только одну из всех возможных реакций, в которые может вступать субстрат. Специфичность действия определяется в основном особенностями строения каталитического участка активного центра фермента.
Субстратная специфичность - способность фермента действовать только на определенные субстраты.
|
|
|
Различают две разновидности субстратной специфичности: абсолютную и относительную.
Фермент, обладающий абсолютной субстратной специфичностью, катализирует превращения только одного субстрата. На другие вещества, даже очень близкие по строению к этому субстрату, фермент не действует. Примером фермента с абсолютной субстратной специфичностью является аргиназа - фермент, отщепляющий от аминокислоты аргинина мочевину. Аргинин - единственный субстрат аргиназы.
Относительная (групповая) субстратная специфичность - это способность фермента катализировать превращения нескольких похожих по строению веществ. Обычно эти вещества обладают одним и тем же типом химической связи и одинаковой структурой одной из химических группировок, соединенных этой связью. Например, фермент пепсин расщепляет пептидные связи в белках любого строения.
Субстратная специфичность обусловлена главным образом структурой адсорбционного участка активного центра фермента.
ИЗОФЕРМЕНТЫ
Изоферменты (изоэнзимы) - различные молекулярные формы фермента, катализирующие одну и ту же химическую реакцию. Обычно между изоферментами одного и того же фермента имеются различия в первичной структуре, т. е. у изофермеитов может быть различный набор и последовательность аминокислот в полипептидной цепи. Но эти различия, как правило, не затрагивают структуру каталитического участка активного центра, и поэтому изоферменты одного и того же фермента ускоряют одну и ту же химическую реакцию. Различия в аминокислотном составе молекул изофермеитов вне каталитического участка приводят к изменениям их физико-химических свойств и субстратной специфичности.
КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Скорость ферментативных реакций существенно зависит от многих факторов. К ним относятся концентрации участников ферментативного катализа (фермента и субстрата) и условия среды, в которой протекает ферментативная реакция (температура, рН, присутствие ингибиторов и активаторов).
Зависимость скорости ферментативной реакции от концентрации фермента
Для большинства ферментов зависимость скорости реакции от концентрации фермента (при постоянной концентрации субстрата) носит прямолинейный характер (рис. 2).
|
|
|
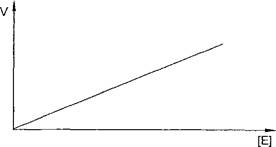 Рис. 2. Зависимость скорости ферментативной реакции от концентрации фермента
Рис. 2. Зависимость скорости ферментативной реакции от концентрации фермента
|
Такой характер зависимости скорости от концентрации фермента объясняется тем, что концентрация любого фермента на несколько порядков ниже концентрации субстрата. Поэтому практически при любом Увеличении количества фермента субстрата всегда будет достаточно Для взаимодействия с ферментом.
Зависимость скорости ферментативной реакции от концентрации субстрата
Пропорциональная зависимость скорости реакции от концентрации субстрата наблюдается лишь при его низких концентрациях, затем постепенно прирост скорости реакции начинает отставать от роста концентрации субстрата, и в конце концов увеличение концентрации субстрата перестает вызывать возрастание скорости реакции. Скорость ферментативных реакций при высоких концентрациях субстрата приближается к определенному пределу, который называется максимальной скоростью - Vmax (рис. 3).
 Рис. 3. Зависимость скорости ферментативной реакции от концентрации субстрата
Рис. 3. Зависимость скорости ферментативной реакции от концентрации субстрата
|
Физический смысл этого явления заключается в следующем: при очень низких концентрациях субстрата скорость реакции зависит от скорости поступления молекул субстрата на активный центр фермента. По мере роста концентрации субстрата количество свободных активных центров уменьшается, так как фермент переходит в фермент- субстратный комплекс и лимитирующей стадией катализа теперь будет не присоединение субстрата к активному центру фермента, а дальнейшие превращения фермент-субстратного комплекса. При очень высоких концентрациях субстрата свободного фермента больше не будет, он весь находится в составе фермент-субстратного комплекса. В этом случае скорость ферментативной реакции станет максимальной и будет обусловлена концентрацией фермент-субстратного комплекса, т. е. концентрацией фермента.
Зависимость скорости ферментативной реакции
от температуры
График зависимости скорости ферментативной реакции от температуры имеет колоколообразный характер (рис. 4). Вначале повышение температуры вызывает возрастание скорости ферментативной реакции, затем скорость реакции достигает максимума, и при дальнейшем увеличении температуры скорость реакции снижается вплоть до ее прекращения. Температура, при которой отмечается наибольшая скорость реакции, называется температурным оптимумом реакции - t°opt.
|
|
|
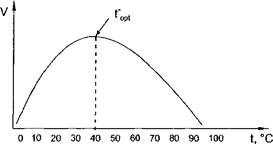 Рис. 4. Зависимость скорости ферментативной реакции от температуры
Рис. 4. Зависимость скорости ферментативной реакции от температуры
|
Возрастание ферментативной активности при повышении температуры от низких величин до температурного оптимума (левая ветвь кривой на рис. 4) объясняется увеличением среднего энергетического уровня и числа столкновений реагирующих молекул с ростом температуры. Согласно правилу Вант-Гоффа, повышение температуры на 10 °С вызывает увеличение скорости химической реакции в 2-4 раза. Это правило относится ко всем химическим реакциям, в том числе к ферментативным.
Снижение активности ферментов при повышении температуры выше температурного оптимума (правая ветвь кривой на рис. 4) объясняется тепловой денатурацией ферментного белка, которая при высоких температурах (80-100 °С) вызывает полную потерю каталитической активности фермента.
Для большинства ферментов температурный оптимум равен 37-40 °С, т. е. соответствует температуре тела. В очень коротких опытах температурный оптимум может быть более высоким, так как за очень малое время Денатурация фермента произойти не успевает.
Как видно на рис. 4, при очень низких (ниже 0 °С) и высоких (80- 100 °С) температурах активность ферментов равна нулю. Однако при низких температурах ферменты сохраняют свою нативность и при повышении температуры у них вновь появляется каталитическая активность. В настоящее время ферменты выделяют из растворов путем лиоф ильной сушки, т. е. сушки в замороженном состоянии при очень низком давлении. Полученные таким образом лиофилизированные ферментные препараты хорошо сохраняются в течение длительного времени даже при комнатной температуре.
Действие же высоких температур приводит к необратимой потере ферментами способности ускорять химические реакции, так как в этом случае происходит их необратимая денатурация. Поэтому на практике для подавления ферментативной активности (например, ферментов микробов, вызывающих порчу пищевых продуктов) обычно используется термическая обработка.
Зависимость скорости ферментативной реакции от рН
Скорость ферментативных реакций значительно зависит от кислотности среды, в которой они протекают. Для каждого фермента имеется определенное значение рН, при котором наблюдается наибольшая скорость реакции — рН-оптимум. При отклонении в любую сторону от этого значения рН резко уменьшается ферментативная активность. Важно подчеркнуть, что величина рН-оптимума у разных ферментов колеблется в большом диапазоне значений рН, в то время как температурный оптимум для большинства ферментов составляет 37-40 °С. В качестве примера можно привести значения рН-оптимума следующих ферментов (рис. 5):
пепсин желудочного сока - 1,0-2,0 амилаза слюны - 6,8-7,0 щелочная фосфатаза плазмы крови - 9,0-10,0
 Рис. 5. Зависимость скорости ферментативной реакции от рН (1 - пепсин, 2 - амилаза, 3 - щелочная фосфатаза)
Рис. 5. Зависимость скорости ферментативной реакции от рН (1 - пепсин, 2 - амилаза, 3 - щелочная фосфатаза)
|
Влияние кислотности среды на скорость ферментативных реакций обусловлено тем, что при изменении кислотности меняется конформация всей белковой молекулы фермента, в том числе изменяется конформация активного центра и его способность осуществлять катализ. При рН-оптимуме фермент находится в оптимальной для проявления каталитических свойств конформации. При небольшом отклонении величины кислотности от рН-оптимума наблюдается незначительное изменение конформации, носящее обратимый характер. При значитель- н0м отклонении от рН-оптимума (в сильнокислой и сильнощелочной среде) происходит необратимая денатурация ферментного белка, приводящая к полной утрате каталитической активности.
При работе с ферментами в лабораторных условиях в реакционную среду вводят буферные растворы, рН которых соответствует рН-оптимуму изучаемых ферментов.
Ингибиторы ферментов
Скорость ферментативной реакции существенно зависит от присутствия ингибиторов и активаторов.
Ингибиторы (I) - это химические соединения (обычно низкомолекулярные), которые, находясь в низких концентрациях, избирательно тормозят определенные ферментативные реакции. При этом ингибитор всегда присоединяется к ферменту с образованием фермент- ингибиторного комплекса. Фермент, связанный с ингибитором, теряет свою каталитическую активность.
Если связи между ферментом и ингибитором прочные, то действие ингибитора носит необратимый характер, и торможение нарастает во времени вплоть до полного прекращения ферментативной реакции:
Е + I--------- EI
Такие ингибиторы называются необратимыми. Примером необратимых ингибиторов являются фосфорорганические соединения (табун, зарин, дихлофос, карбофос и др.), избирательно и необратимо угнетающие важнейший фермент организма холинэстеразу, участвующую в передаче нервных импульсов.
Если ингибитор присоединяется к ферменту за счет непрочных связей, то торможение фермента является обратимым и не зависит от времени:
Е + I == EI
Ингибиторы такого типа называются обратимыми.
В свою очередь, обратимые ингибиторы делятся на две разновидности: конкурентные и неконкурентные.
Конкурентные ингибиторы присоединяются к активному центру фермента, т. е. к тому же участку поверхности фермента, что и субстрат. Поэтому между ингибитором и субстратом идет конкуренция за присоединение к активному центру. Занимая активный центр, ингибитор тем самым препятствует образованию фермент-субстратного комплекса - первой стадии ферментативного катализа. Конкурентные ингибиторы обычно по с троению похожи на субстрат.
Неконкурентные ингибиторы присоединяются к ферменту вне активного центра. Этот участок поверхности фермента называется алло- стерический центр (т. е. находящийся в другом месте по сравнению с активным центром).
Присоединение неконкурентного ингибитора к аллостерическому центру вызывает неблагоприятное изменение пространственной структуры (конформации) всей молекулы фермента, в том числе и активного центра. В результате каталитические свойства фермента снижаются.
Неконкурентные ингибиторы участвуют в регуляции скорости ферментативных реакций, протекающих в организме. В роли неконкурентных ингибиторов могут быть гормоны, конечные и промежуточные продукты ферментативных реакций, ионы металлов, лекарственные вещества.
Активаторы ферментов
Активаторы - вещества, избирательно повышающие скорость определенных ферментативных реакций. Активаторы, подобно неконкурентным ингибиторам, присоединяются обратимо к аллостерическому центру фермента. Но в этом случае изменение конформации фермента будет благоприятным для функционирования активного центра, что приводит в итоге к повышению скорости ферментативной реакции. В организме активаторами являются некоторые гормоны, промежуточные продукты метаболических процессов, ионы металлов, а также лекарственные препараты.
РЕГУЛЯЦИЯ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
зования новых ферментов их содержание в клетках возрастает. При этом скорость ферментативных реакций увеличивается, так как зависимость скорости реакции от концентрации фермента носит прямолинейный характер.
При уменьшении выработки ферментов их концентрация в клетках постепенно снижается, что сопровождается падением скорости катализируемых ими реакций.
Изменение скорости синтеза ферментов обычно происходит под влиянием гормонов, которые ускоряют или замедляют первый этап синтеза ферментных белков - считывание генетической информации - транскрипцию. Поэтому данный механизм регуляции часто называется регуляцией на генетическом уровне.
• Модификация ферментов. Под модификацией понимается незначительное изменение химического состава молекулы фермента, приводящее к изменению каталитической активности.
Модификация может быть обратимой и необратимой.
В первом случае изменение строения фермента носит обратимый характер и фермент может многократно менять свою активность. Например, некоторые ферменты содержат в своей молекуле остаток фосфорной кислоты. При отщеплении фосфатного остатка у одних ферментов каталитическая активность снижается; при включении его снова в состав ферментов активность их возрастает. У других же ферментов фосфорилированная форма (содержащая фосфат), наоборот, малоактивна. Отщепление фосфорной кислоты от таких ферментов ведет к повышению их активности.
Примером необратимой модификации служит активация пищеварительных ферментов, действующих на пищевые белки. Так, в составе желудочного сока содержится белок пепсиноген, не обладающий каталитической активностью. В полости желудка под действием соляной кислоты от этого белка отщепляется небольшой полипептид и образуется очень активный фермент, расщепляющий в пищевых белках пептидные связи, - пепсин. (Белки, являющиеся предшественниками ферментов, называются проферментами.)
• Изменение конформации ферментов. Изменение конформации, т. е. пространственного строения ферментного белка, происходит под действием неконкурентных ингибиторов и активаторов, которыми могут быть гормоны, промежуточные и конечные продукты ферментативных реакций, ионы металлов, лекарства (см. выше). Изменение конформации ферментов возможно и при изменении условий среды, например при повышении или снижении кислотности.
КЛАССИФИКАЦИЯ И ИНДЕКСАЦИЯ ФЕРМЕНТОВ
Современная классификация ферментов основывается на характере химической реакции, катализируемой ферментом. Все ферменты делятся на шесть классов в зависимости от типа катализируемой реакции:
I класс — оксидоредуктазы — ферменты, катализирующие окислительно-восстановительные реакции.
Схематично действие ферментов I класса можно записать:
А+В ---- C + D
II класс - трансферазы - ферменты, катализирующие перенос химических группировок с молекулы одного вещества на молекулу другого:
АВ + С--------- А + ВС
III класс - гидролазы - ферменты, расщепляющие химические связи путем присоединения воды, т. е. путем гидролиза:
АВ + Нуэ--------- А-Н + В-ОН
IV класс - лиазы - ферменты, катализирующие расщепление химических связей без присоединения воды:
АВ--- А+В
V класс — изомеразы - ферменты, катализирующие изомерные превращения, т. е. перенос отдельных химических групп в пределах одной молекулы:
А -------- В
VI класс - синтетазы - ферменты, катализирующие реакции синтеза, протекающие за счет энергии гидролиза АТФ:
А+В ^ АВ
АТФ + НгО ^ ^ АДФ + Н3Р04
Каждый класс, в свою очередь, делится на подклассы, внутри подклассов выделены подподклассы. Каждый подподкласс содержит список индивидуальных ферментов в строго определенной последовательности, которая не изменяется, а лишь продлевается по мере открытия новых ферментов.
В основе подразделения ферментов на подклассы и на подподклас- сы лежит тип химической связи или химическое строение группировки субстрата, на которую действует фермент.
С классификацией ферментов тесно связана их индексация (нумерация)- Индекс (шифр) каждого фермента состоит из четырех чисел, разделенных точками, и составляется по следующему принципу: первая цифра индекса указывает, к какому из шести классов принадлежит данный фермент. Второе и третье числа индекса обозначают соответственно порядковые номера подклассов и подподклассов. Четвертое число индекса - порядковый номер индивидуального фермента внутри своего подподкласса.
Например, фермент слюны амилаза, расщепляющий крахмал, имеет индекс 3.2.1.1, что свидетельствует о принадлежности этого фермента к классу гидролаз.
НОМЕНКЛАТУРА ФЕРМЕНТОВ
Название фермента, как правило, состоит из двух частей. Первая часть является названием субстрата, превращения которого катализируется данным ферментом. Вторая часть названия, имеющая окончание «-аза», указывает природу реакции. Например, фермент, отщепляющий от лактата (молочная кислота) атомы водорода, называется лактатде- гидрогеназа; фермент, катализирующий изомеризацию глюкозо-6- фосфата в фруктозо-6-фосфат, имеет название глюкозофосфатизомера- за, а фермент, участвующий в синтезе гликогена, - гликогенсинтетаза.
Полезная информация
Энергия активации - избыток энергии (выше среднего), которым должны обладать молекулы, чтобы их столкновение оказалось продуктивным, т. е. привело бы к химической реакции. Изменение величины энергии активации в большой мере влияет на скорость реакции: незначительное уменьшение энергии активации приводит к резкому повышению скорости реакции, и, наоборот, самое небольшое ее возрастание сопровождается весьма значительным снижением скорости.
ГЛАВА 4
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Как уже отмечалось, в процессе обмена веществ в организме происходят различные реакции окисления, которые объединяют термином биологическое окисление.
Основным типом биологического окисления является тканевое дыхание, протекающее в клеточных митохондриях (в связи с этим тканевое дыхание еще называется митохондриальным окислением).
ТКАНЕВОЕ ДЫХАНИЕ______________________________________________
Тканевое дыхание - это основной способ получения АТФ, используемый всеми клетками организма (кроме красных клеток крови).
В процессе тканевого дыхания от окисляемого вещества отнимаются два атома водорода (два протона и два электрона) и по дыхательной цепи, состоящей из ферментов и коферментов, передаются на молекулярный кислород - 02, доставляемый кровью из воздуха во все ткани организма. В результате присоединения атомов водорода к кислороду образуется вода. За счет энергии, выделяющейся при движении электронов по дыхательной цепи, в митохондриях осуществляется синтез АТФ из АДФ и фосфорной кислоты. Обычно образование одной молекулы воды сопровождается синтезом трех молекул АТФ.
В упрощенном виде тканевое дыхание может быть представлено следующей схемой:
АН2 + 1/2 02 А + Н20
Окисляемое У Окисленное
вещество, вещество
3 АДФ + 3 Н3Р04 з АТФ
В качестве субстратов окисления (т. е. веществ, от которых отнимается водород) в тканевом дыхании используются разнообразные промежуточные продукты распада белков, углеводов и жиров. Однако наиболее часто окислению подвергаются промежуточные продукты цикла трикарбоновых кислот (ЦТК) - цикла Кребса (изолимонная, а-кетоглутаровая, янтарная и яблочная кислоты). Цикл Кребса - это завершающий этап катаболизма, в ходе которого происходит окисление остатка уксусной кислоты, входящей в ацетилкофермент А, до С02 и Н20. В свою очередь, ацетилкофермент А - это универсальный метаболит организма, в который при своем распаде превращаются главные органические вещества - белки, углеводы и жиры (подробнее см. в главе 5 «Обмен углеводов»).
Тканевое дыхание представляет собой сложный ферментативный процесс. Все ферменты тканевого дыхания делятся на три группы: нико- тинамидные дегидрогеназы, флавиновые дегидрогеназы и цитохромы.
Никотинамидные дегидрогеназы отнимают два атома водорода от окисляемого субстрата и временно присоединяют их к своему кофер- менту НАД (никотинамидадениндинуклеотид). По строению НАД является динуклеотидом, в котором два нуклеотида соединяются между собой остатками фосфорной кислоты. В состав одного из нуклеотидов в качестве азотистого основания входит амид никотиновой кислоты (иикотинамид, витамин РР), вторым нуклеотидом является адено- зиимоиофосфат (АМФ):
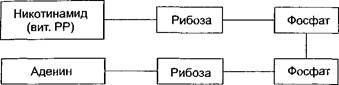
|
Отнимаемые от окисляемого вещества атомы водорода присоединяются непосредственно к никотинамиду (отсюда название данных ферментов - никотинамидные дегидрогеназы), при этом НАД переходит в свою восстановленную форму НАД Н2:
АН2 + НАД ------------ — А + НАДН2
Окисляемое Окисленное
вещество вещество
Флавиновые дегидрогеназы отщепляют два атома водорода от образовавшегося НАД Н2 и временно присоединяют их к своему кофер- менту ФМН (флавинмононуклеотид). По строению этот кофермент является мононуклеотидом, содержащим витамин В2 (рибофлавин):
 Рибофлавин (витамин В2)
Рибофлавин (витамин В2)
|
Два атома водорода, отнимаемые флавиновыми дегидрогеназами от восстановленного НАД (НАД Н2), присоединяются к флавину, выполняющему роль акцептора водорода. В результате этой стадии образуется восстановленная форма кофермента - ФМН Н2:
НАД-Н2 + ФМН-------- ^ НАД + ФМН-Н2
В некоторых случаях флавиновые дегидрогеназы, подобно никоти- намидным, отнимают два атома водорода непосредственно от окисляемых веществ. Такие флавиновые дегидрогеназы используют кофермент ФАД (флавинадениндинуклеотид), похожий по строению на ФМН и тоже содержащий витамин В2:
АН2 + ФАД --------- —А + ФАД-Н2
Окисляемое Окисленное
вещество вещество
Следующая группа ферментов - цитохромы. Эти ферменты участвуют только в переносе электронов. По строению цитохромы похожи на одну из субъединиц гемоглобина. Молекула цитохрома состоит из полипептида и гема. Но в отличие от гемоглобина железо, входящее в гем цитохромов, имеет переменную валентность. Способность железа обратимо переходить из окисленной формы в восстановленную (Fe3+ + е - - Fe2+) обеспечивает возможность переноса электронов данными ферментами.
С помощью цитохромов (их имеется несколько: Ь, с, а, а3) электроны от восстановленных коферментов ФМНН2 и ФАД-Н2 передаются на молекулярный кислород (02), который при этом переходит в активную, анионную, форму - О2-. Далее активный кислород (О2") связывается с ионами водорода (протонами), которые тоже отщепляются от ФМН Н2 или от ФАД-Н2. Присоединение ионов водорода к аниону кислорода приводит к образованию воды.
Таким образом, на всем протяжении дыхательной цепи наблюдается передвижение электронов. Движение электронов вызвано тем, что все участники дыхательной цепи располагаются по мере возрастания их окислительно-восстановительных потенциалов.
Окислительно-восстановительный потенциал, или редокс-потенци- ал, характеризует способность вещества принимать и удерживать электроны. Поэтому электроны переносятся от вещества с низким редокс-потенциалом к веществу с более высоким редокс-потенциалом.
Поскольку самое низкое значение редокс-потенциала имеет окисляемое вещество, а самое высокое - кислород, то в итоге электроны от окисляемого вещества поступают на молекулу кислорода.
Как уже отмечалось, движение электронов по дыхательной цепи сопровождается выделением энергии. Около половины энергии движения электронов аккумулируется в макроэргических связях молекул АТФ. Другая часть энергии выделяется в виде тепла. Синтез АТФ происходит при переносе электронов с НАД-Н2 на ФМН, с цитохрома b на ци- тохром с и с цитохрома а на цитохром а3. Всего при переносе двух атомов водорода на кислород (т. е. в расчете на одну образовавшуюся молекулу воды) синтезируется три молекулы АТФ.
Некоторые субстраты (жирные кислоты, янтарная кислота и др.) имеют более высокийредокс-потенциал, чем НАД. Поэтому они не мо
гут окисляться никотинамидными дегидрогеназами. В этом случае отнятие атомов водорода от таких субстратов осуществляется флавиновыми дегидрогеназами. Из-за отсутствия никотинамидных дегидрогеназ при окислении таких веществ образуется только две молекулы АТФ.
На рис. 6 представлена схема тканевого дыхания, включающая все группы ферментов.
Образование АТФ в процессе тканевого дыхания часто обозначается терминами: окислительное фосфорилирование, дыхательное фосфорилирование, аэробное фосфорилирование, или аэробный синтез АТФ.
н2о
| -> 2Н+ |
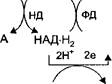
| '2Н+ 2е |
| ФМН |
JL
2е 1 2е * 1 2е т
АН2 НАД ФМНН2 2F е3' _2Fe2".2Fe3_ -2Fe2+x 1/202
V V Y V Y
I цит. b V цит. с ] цит. a J цит. а3 I
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 777; Нарушение авторских прав?; Мы поможем в написании вашей работы!