
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Архимеда
|
|
|
|
Этиловый спирт;
Вода;
А, б, в;
3) 7;
2) 7;
4) 8.
3) 15;
2) 5;
А, г;
А, б;
А, в;
4) 3.
1) 10;
4) 2.
Б, г;
Окисление;
Восстановление;
Восстановление;
Окисление;
2) 80;
4) 17.
4) 35,5.
4) 12,25.
3) 52,83;
4) 36,5.
3) 158;
2) 52,67;
1) 31,6;
1) 166;
3) 32,67;
2) 49;
2) 98;
3) 26;
1) 39;
2) 78;
А, г;
1) 1;
4) 1/5.
А;
1) 1;
Б.
1) 1;
2) 1;
3) 1;
4) 1.
В 1л раствора содержится 3 моль глюкозы;
В 100 г раствора содержится 0,89 г NaCl;
Б, в, г;
Масса 1 моль эквивалента вещества Х;
Моль вещества содержится в 1кг растворителя;
Граммов вещества содержится в 1 мл раствора;
Б, в;
А;
Реальной или условной частицы вещества Х эквивалента одному протону или одному электрону в данной реакции;
Реальной или условной частицей вещества;
Реальная или условная частица вещества, которая в данной реакции эквивалентна одному протону или одному электрону;
Моль вещества эквивалента содержится в 1л раствора.
Моль вещества содержится в 1 л раствора;
Граммов вещества содержится в 100 г раствора;
Все;
2) б, в, г, д;
3) а, д, е;
4) б, в, г, е.
7. Дополните. Для обеспечения энергоресурсов организма в медицине используют инфузионные растворы ________________________________.
8. Дополните. При интоксикации организма различной этиологии в инфузионно-трансфузионной терапии используют _______________ растворы.
9. Дополните. Моль – это единица _________________ вещества.
10. Массовая доля вещества Х в растворе, выраженная в % показывает, сколько:
2) граммов вещества содержится в 100 мл раствора;
3) граммов вещества содержится в 1000 мл раствора;
4) граммов вещества содержится в 1 кг раствора.
11. Молярная концентрация вещества Х показывает, сколько:
1) моль вещества содержится в 100 мл раствора;
3) моль вещества содержится в 1 кг раствора;
4) моль вещества содержится в 1 кг растворителя.
12. молярная концентрация эквивалента вещества Х показывает, сколько:
1) моль вещества содержится в 1л раствора;
2) моль вещества содержится в 1кг раствора;
3) моль вещества эквивалента содержится в 1кг раствора;
13. эквивалент вещества – это:
1) реальная частица вещества, которая в данной реакции эквивалентна одному протону или одному электрону;
2) условная частица вещества, которая в данной реакции эквивалентна одному протону или одному электрону;
4) реальная частица вещества, которая эквивалентна только одному протону.
14. Эквивалент вещества может быть:
1) только реальной частицей вещества;
2) только условной частицей вещества;
4) все ответы неверны.
15. Фактор эквивалентности – это число, показывающее, какая доля:
1) реальной частицы вещества Х эквивалентна одному протону в кислотно-основной реакции или одному электрону в ОВР;
2) условной частицы вещества Х эквивалентна одному протону или одному электрону в данной реакции;
4) все ответы неверны.
16. Фактор эквивалентности не может принимать значения: а) >1; б) <1; в) равное 1.
1) б;
2) б, в;
4) а, б.
17. Фактор эквивалентности может принимать значения: а) >1; б) <1; в) равное 1.
1) а, б;
3) а, б, в;
4) а, в.
18. Титр показывает, сколько:
2) граммов вещества содержится в 1л раствора;
3) граммов вещества содержится в 1 кг растворителя;
4) моль вещества содержится в 1л раствора.
19. Молярная концентрация вещества Х показывает, сколько:
1) моль вещества содержится в 100 мл раствора;
2) моль вещества содержится в 100 мл растворителя;
4) моль вещества содержится в 1л растворителя.
20. Молярная масса эквивалента вещества Х – это:
2) масса 1 моль вещества Х;
3) произведение количества вещества Х на его молярную массу;
4) отношение массы вещества Х к его количеству.
21. Молярная концентрация вещества Х и молярная концентрация эквивалента вещества Х имеют одно и то же численное значение, если фактор эквивалентности:
1) >1;
2) =1;
3) <1;
4) величина фактора эквивалентности не имеет значения.
22. Дополните. Предельно допустимая концентрация (ПДК) загрязняющих веществ – это ________________ содержание веществ в единице объёма воздуха или воды.
23. Дополните. Объёмное процентное содержание вещества в растворе показывает, сколько мл жидкого вещества содержится в _______ раствора.
24. Установите соответствие.
Способ выражения
концентрации вещества
1) массовая доля вещества Х
2) молярная концентрация вещества Х
3) Молярная концентрация эквивалента вещества Х
4) молярная доля вещества Х
Размерность в СИ
А) моль/кг
Б) безразмерная (доли единицы или %)
В) моль/м3
Г) г/см3
25. Установите соответствие.
Способ выражения концентрации вещества
1) массовая доля вещества Х
2) титр вещества Х
3) титр по определяемому веществу А
4) молярная концентрация вещества Х
Математическое выражение
А) 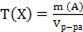 ;
;
Б) 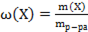 ;
;
В) 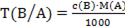 ;
;
Г) 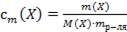 ;
;
Д) 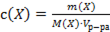 .
.
26. Установите соответствие.
Способ выражения концентрации вещества
1) молярная концентрация эквивалента вещества Х
2) молярная доля вещества Х
3) молярная концентрация вещества Х
4) массовая доля вещества Х
Математическое выражение
А) 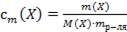 ;
;
Б) 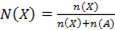 ;
;
В) 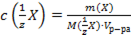 ;
;
Г) 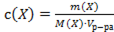 ;
;
Д) 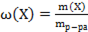 .
.
27. К внесистемным единицам выражения состава раствора относится: а) молярная концентрация вещества Х; б) титр вещества Х; в) жёсткость воды; г) предельно допустимая концентрация загрязняющих веществ; д) молярная доля вещества.
1) все;
2) а, д;
4) в, г.
28. Способу выражения концентрации вещества Х в растворе «массовая доля» не соответствует математическое выражение её:
1) 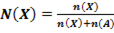 ;
;
2) 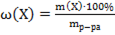 ;
;
3) 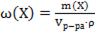 ;
;
4) 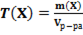 .
.
29. Способу выражения концентрации вещества Х в растворе «молярная концентрация эквивалента» не соответствует математическое выражение её:
1) 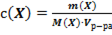 ;
;
2) 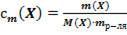 ;
;
3) 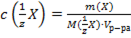 ;
;
4) 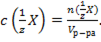
30. Способу выражения концентрации вещества Х в растворе «молярная концентрация» не соответствует математическое выражение её:
1) 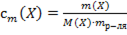 ;
;
2) 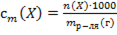 ;
;
3) 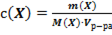 ;
;
4) 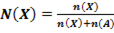 .
.
31. Изотонический раствор – это:
1) 0,89%-ный раствор NaCl;
2) 0,089%-ный раствор NaCl;
3) 8,9%-ный раствор NaCl;
4) 1,00%-ный раствор NaCl.
32. Запись «0,89%-ный раствор NaCl» означает, что:
2) в 100 мл раствора содержится 0,89 г NaCl;
3) в 1л раствора содержится 0,89 г NaCl;
4) в 1кг раствора содержится 0,89 г NaCl.
33. Запись «3М раствор глюкозы» означает, что:
2) в 100 мл раствора содержится 3 моль глюкозы;
3) в 1кг раствора содержится 3 моль глюкозы;
4) в 100 г раствора содержится 3 моль глюкозы.
34. Запись «0,25 н. раствор H2SO4» означает, что:
1) в 1л раствора содержится 0,25 моль H2SO4;
2) в 1кг раствора содержится 0,25 моль эквивалента H2SO4;
3) в 1л раствора содержится 0,25 моль эквивалентаH2SO4;
4) в 1л растворителя содержится 0,25 моль H2SO4.
35. Фактор эквивалентности гидроксида алюминия в реакции Al (OH)3 + 3HCl=… равен:
1) 1/3;
2) ½;
3) 3;
4) 1/6.
36. Фактор эквивалентности гидроксида алюминия в реакции Al (OH)3 + 2HCl=… равен:
1) 1/3;
2) ½;
3) 1/6;
4) 2.
37. Фактор эквивалентности гидроксида алюминия в реакции Al (OH)3 + HCl=… равен:
1) 1/3;
2) ½;
3) 1/6;
38. Фактор эквивалентности гидроксида натрия в реакции H3PO4 + 3NaOH=… равен:
1) ½;
2) 1/3;
4) 3.
39. Фактор эквивалентности гидроксида натрия в реакции H3PO4 + 2NaOH=… равен:
1) ½;
3) 1/3;
4) 3.
40. Фактор эквивалентности гидроксида натрия в реакции H3PO4 + NaOH=… равен:
2) ½;
3) 1/3;
4) 2.
41. Фактор эквивалентности равен ½ в следующих схемах химических реакций: а) Fe (OH)3 + 3HCl=…; б) H2SO4 + 2NaOH=…; в) H2SO4 + NaOH=…; г) H2S + NaOH=…:
1) а, б;
2) в, г;
3) б, в, г;
42. Фактор эквивалентности ортофосфорной кислоты в реакции H3PO4 + 3NaOH=… равен:
1) 1;
2) ½;
3) 1/3;
4) 2.
43. Фактор эквивалентности ортофосфорной кислоты в реакции H3PO4 + 2NaOH=… равен:
1) 1;
2) ½;
3) 1/3;
4) 2.
44. Фактор эквивалентности ортофосфорной кислоты в реакции H3PO4 + NaOH=… равен:
2) ½;
3) 1/3;
4) 2.
45. Фактор эквивалентности H2SO4 равен 1 в следующих схемах химических реакций: а) H2SO4 + NaOH=…; б) H2SO4 + 2NaOH=…; в) H2SO4 + Ca (OH)2=…; г) H2SO4 +Mg=…:
1) в, г;
3) а, б;
4) б, в, г.
46. Фактор эквивалентности тетрабората натрия в реакции Na2B4O7 + 2HCl +5H2O=… равен:
1) 1;
2) 1/5;
3) ½;
4) 1/10.
47. Фактор эквивалентности перманганата калия в реакции KMnO4 + Na2SO3 + H2SO4=… равен:
1) 1;
2) 1/10;
3) ½;
48. Фактор эквивалентности перманганата калия в реакции KMnO4 + Na2SO4 + H2O=… равен:
1) 1/5;
2) 1/6;
3) 1/3;
4) ½.
49. Фактор эквивалентности перманганата калия в реакции KMnO4 + NaNO2 + NaOH=… равен:
2) ½;
3) 1/5;
4) 1/3.
50. Фактор эквивалентности щавелевой кислоты в реакции H2C2O4 + KMnO4 + H2SO4=… равен:
1) 1/10;
2) 1/5;
3) 5;
4) ½.
51. Фактор эквивалентности пероксида водорода в реакции KMnO4 + H2O2 + H2SO4=… равен:
1) 1/10;
2) 1/5;
3) ½;
4) 5.
52. Фактор эквивалентности вещества KMnO4 равен 1/5 в следующих схемах реакций: а) KMnO4 + H2SO4 + NaNO2=MnSO4 + NaNO3 + K2SO4 + H2O; б) KMnO4 + KOH + NaNO2=K2MnO4 + NaNO3 + H2O; в) KMnO4 + H2O + NaNO2=MnO2 + NaNO3 + KOH; г) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O.
1) б, в;
2) а;
4) а, в.
53. Фактор эквивалентности вещества KMnO4 равен 1/3 в следующих схемах реакций:
1) KMnO4 + H2SO4 + NaNO2=MnSO4 + NaNO3 + K2SO4 + H2O;
2) KMnO4 + KOH + NaNO2=K2MnO4 + NaNO3 + H2O;
3) KMnO4 + H2O + NaNO2=MnO2 + NaNO3 + KOH;
4) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O.
54. Фактор эквивалентности вещества KMnO4 равен 1 в следующих схемах реакций:
1) KMnO4 + H2SO4 + NaNO2=MnSO4 + NaNO3 + K2SO4 + H2O;
2) KMnO4 + KOH + NaNO2=K2MnO4 + NaNO3 + H2O;
3) KMnO4 + H2O + NaNO2=MnO2 + NaNO3 + KOH;
4) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O.
55. Фактор эквивалентности вещества KMnO4 не принимает значение 1/5 в следующих схемах реакций:
1) KMnO4 + NaOH + Na2SO3=K2MnO4 + Na2MnO4 + Na2SO4 + H2O;
2) KMnO4 + H2SO4 + Na2SO3=MnSO4 + K2SO4 + Na2SO4 + H2O;
3) KMnO4 + FeSO4 + H2SO4=MnSO4 + Fe2(SO4)3 + K2SO4 + H2O;
4) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O.
56. Фактор эквивалентности вещества KMnO4 не принимает значение 1/3 в следующих схемах реакций:
1) KMnO4 + FeSO4 + H2SO4=MnSO4 + Fe2(SO4)3 + K2SO4 + H2O;
2) KMnO4 + N2O + H2SO4=MnSO4 + HNO3 + K2SO4 + H2O;
3) KMnO4 + H2O + Na2SO3=MnO2 + KOH + Na2SO4;
4) KMnO4 + C2H2 = K2C2O4 + MnO2 + KOH.
57. Установите соответствие.
Схема ОВР
1) KMnO4 + N2O + H2SO4=
MnSO4 + HNO3 + K2SO4 + H2O;
2) Mn (OH)4 + Br2 + KOH = K2MnO4 + KBr + H2O;
3) KMnO4 + KOH + NaNO2= K2MnO4 + NaNO3 + H2O;
4) Na [Cr (OH)4] + Cl2 + NaOH = Na2Cr2O4 + NaCl + H2O.
Значение фактора эквивалентности
А) ¼;
Б) 1/5;
В) ½;
Г) 1;
Д) 1/3.
58. Установите соответствие.
Схема ОВР
1) KMnO4 + N2O + H2SO4=MnSO4 + HNO3 + K2SO4 + H2O;
2) K2CrO4 + KHSO3 + H2O = Cr (OH)3 + K2SO4 + KOH;
3) Na2SO3 + KI + H2SO4 = Na2S + I2+ K2SO4 + H2O;
4) NH3 + H2O2= N2+H2O.
Значение фактора эквивалентности
А) ½
Б) ¼
В) 1
Г) 1/3
Д) 1/8
59. Молярная масса эквивалента Al (OH)3 (г/моль) в реакции Al (OH)3 + HCl = … равна:
1) 39;
3) 26;
4) 13.
60. Молярная масса эквивалента Al (OH)3 (г/моль) в реакции Al (OH)3 + 2HCl = … равна:
2) 78;
3) 26;
4) 13.
61. Молярная масса эквивалента Al (OH)3 (г/моль) в реакции Al (OH)3 + 3HCl = … равна:
1) 39;
2) 78;
4) 13.
62. Молярная масса эквивалента H3PO4 (г/моль) в реакции H3PO4+ NaOH = … равна:
1) 49;
3) 32,67;
4) 40.
63. Молярная масса эквивалента H3PO4 (г/моль) в реакции H3PO4+ 2NaOH = … равна:
1) 98;
3) 32,67;
4) 196.
64. Молярная масса эквивалента H3PO4 (г/моль) в реакции H3PO4+ 3NaOH = … равна:
1) 98;
2) 49;
4) 196.
65. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: KI + H2SO4 (конц.)= I2 + H2S + K2SO4 + H2O.
2) 83;
3) 98;
4) 12,25.
66. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KMnO4 + H2O2 + H2SO4 = O2 +...
2) 52,67;
3) 158;
4) 17.
67. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KMnO4 + Na2SO3 + H2O =...
1) 31,6;
3) 158;
4) 63.
68. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KMnO4 + Na2SO3 + KOH =...
1) 31,6;
2) 52,67;
4) 63.
69. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: K2Cr2O7 + HCl = Cl2+CrCl3+KCl+H2O.
1) 49;
2) 18,25;
3) 6,08;
70. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: CrCl3 + Br2 +KOH = KCl+K2CrO4+KBr+H2O.
1) 26,42;
2) 79,25;
4) 158,5.
71. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KI + H2SO4 (конц.)= I2 + H2S + K2SO4 + H2O.
1) 83;
2) 98;
3) 166;
72. Определить молярную массу эквивалента окислителя (г/моль) в реакции: Cl2 + H2SO3= HCl + H2SO4 + H2O.
1) 49;
2) 98;
3) 24,5;
73. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: KMnO4 + H2O2 + H2SO4 = O2 +...
1) 31,6;
2) 52,67;
3) 158;
74. Определить молярную массу эквивалента окислителя (г/моль) в реакции: CrCl3 + Br2 +KOH = KCl+K2CrO4+KBr+H2O.
1) 26,42;
3) 52,83;
4) 158,5.
75. Указать процесс, протекающий по схеме SO42-→SO32-:
1) восстановление;
3) диспропорционирование;
4) ОВР не протекает.
76. Указать процесс, протекающий по схеме SO42-→SO2:
2) окисление;
3) диспропорционирование;
4) ОВР не протекает.
77. Указать процесс, протекающий по схеме AlO2-→Al:
2) окисление;
3) диспропорционирование;
4) ОВР не протекает.
78. Указать процесс, протекающий по схеме CrO42-→Cr3+:
1) восстановление;
3) диспропорционирование;
4) ОВР не протекает.
79. Процесс окисления протекает в следующих схемах: а) CrO42-→Cr3+; б) Cl2→ClO3-; в) SO42-→H2S; г) H2C2O4→CO2:
2) а, б;
3) б, в;
4) а, г.
80. Указать число электронов, принимающих участие в процессе NO2-→ NO3-.
1) 3;
2) 0;
3) 1;
81. Указать число электронов, принимающих участие в процессе Cl2→ClO3-:
2) 2;
3) 5;
4) 1.
82. Указать число электронов, принимающих участие в процессе Cr3+ → CrO42-:
1) 5;
2) 8;
3) 1;
83. Процесс восстановления не протекает в следующих схемах: а) Cr3+ → CrO42-; б) BrO3- → Br2; в) SO32-→ SO42-; г) NO3- → NO2-:
1) б, г;
3) б, в;
4) а, г.
84. Указать частицы, принимающие участие в процессах: SO32-→ SO42-; BrO3- → Br2:
1) OH-, H2O;
2) H2O2, H2O;
3) OH-, H+;
4) H2O, OH-.
85. Указать частицы, принимающие участие в процессах: NO3- → NO2-; Br2 → BrO3-:
1) OH-, H2O;
2) H2O2, H2O;
3) OH-, H+;
4) H2O, H+.
86. Молекулы воды не принимают участия в следующих схемах процессов окисления или восстановления: а) Br2→BrO2- (щелочная среда); б) NO3-→NO2 (кислая среда); в) PH3→H3PO4 (кислая среда); г) ClO3-→Cl- (щелочная среда).
1) б, г;
3) б, в;
4) а, г.
87. Молекулы воды не принимают участия в следующих схемах процессов окисления или восстановления: а) ClO3-→Cl- (щелочная среда); б) NO2-→ NO3- (щелочная среда); в) MnO2→MnO42- (щелочная среда); г) C2O42-→CO2.
2) а, б;
3) б, в;
4) в, г.
88. Составить уравнение ОВР ионно-электронным методом и указать коэффициент у восстановителя KMnO4+KNO2+H2SO4→…
1) 2;
3) 10;
4) 7.
89. Составить уравнение ОВР ионно-электронным методом и указать сумму коэффициентов у восстановителя и окислителя K2Cr2O7+HCl → Cl2+CrCl3+KCl+H2O.
1) 14;
2) 1;
4) 6.
90. Составить уравнение ОВР ионно-электронным методом и указать коэффициент у восстановителя KI+H2SO4(конц.)→I2+H2S+K2SO4+ H2O.
1) 2;
2) 5;
3) 13;
91. Составить уравнение ОВР ионно-электронным методом и указать сумму коэффициентов у восстановителя и окислителя KMnO4+KNO2+H2SO4 → …
1) 5;
3) 10;
4) 2.
92. Составить уравнение ОВР ионно-электронным методом и указать сумму коэффициентов у восстановителя и окислителя K2Cr2O7+KI+H2SO4 → Cr2(SO4)3+I2+K2SO4+ H2O.
1) 6;
2) 13;
4) 14.
93. Укажите способы приготовления растворов: а) по навеске; б) из фиксаналов; в) разбавлением более концентрированного раствора.
1) а, б;
2) б, в;
4) а, в.
94. В 20%-ном водном растворе этилового спирта указать растворитель:
1) этиловый спирт;
3) оба ответа верны;
4) оба ответа неверны.
95. В 80%-ном водном растворе этилового спирта указать растворитель:
2) вода;
3) оба ответа верны;
4) оба ответа неверны.
96. Принцип работы ареометра основан на законе:
1) Паскаля;
2) Ньютона;
3) Эйнштейна;
97. Раствор пероксида водорода требуемой концентрации можно приготовить следующим способом:
1) из фиксанала;
2) из навески;
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 1711; Нарушение авторских прав?; Мы поможем в написании вашей работы!