
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу). Альдегидная группа Карбонильная группа Гомологический ряд 2 страница
|
|
|
|
2. Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях - бесцветный горючий газ со слабым запахом. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул. Галогенирование: CH2=CH2 + Cl2 → CH2Cl—CH2Cl Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения. Гидрирование: CH2=CH2 + H - H → CH3 - CH3 (под действием Ni) Гидрогалогенирование: CH2=CH2 + HBr → CH3 - CH2Br Гидратация: CH2=CH2 + HOH → CH3CH2OH этиловый спирт (под действием катализатора) Эту реакцию открыл A.M. Бутлеров, и она используется для промышленного получения этилового спирта. Окисление: Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. Окись этилена — непрочное вещество, кислородный мостик разрывается и присоединяется вода, в результате образуется этиленгликоль: Горение: C2H4 + 3O2 → 2CO2 + 2H2O Полимеризация (получение полиэтилена): nCH2=CH2 → (-CH2-CH2-)n. CH2=CH2-C2H4 этилен (этен) CH2-CH=CH3 или C3H6 пропилен (пропен)CH2=CH CH2-CH3 или C4H8 бутен-1 CH2=CH-CH2-CH2-CH3 или C5H10 пентен-1 и т.д. В молекулах алкенов только одна двойная связь. CnH2nМарковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) атому углерода (в месте разрыва двойной связи).
|
|
|
Билет 22. 1. Кислоты – это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.Кислоты могут быть бескислородными, как соляная HCl, сероводородная H2S, или кислородсодержащими: азотная HNO3, серная H2SO4.В зависимости от числа атомов водорода, кислоты делят на однооснóвные, например, азотная HNO3, двухоснóвные – серная H2SO4, трехснóвные – ортофосфорная (часто называют просто фосфорная) H3PO4.С точки зрения теории электролитической диссоциации кислотами называются вещества, диссоциирующие в растворах с образованием ионов водорода: HCl → H+ + Cl-
2. Алкадиены — органические соединения, содержащие две двойных связи углерод-углерод. Низшие диены - бесцветные легкокипящие жидкости. 1,3-Бутадиен и аллен (1,2-пропадиен) — газы. Общая формула СnH2n-2 n=3 и более, следовательно любой алкадиен является изомером алкина с тем же числом углеводородных атомов. 1. Для алкадиенов характерны реакции присоединения. (+галогены, водород, галогеноводород и т.д.) CH2=CH-CH=CH2+Br2àCH2Br-CH=CH-CH2Br 2.Реакции полимеризации: n(CH2=CH-CH=CH2)à(-CH2-CH=CH-CH2-)n
Билет 23. 1. Степень окисления – мнимый заряд, возникающий на атоме, если считать все связи ионными. ОВР – это реакции, проходящие с изменением степени окисления двух или более элементов, входящих в состав реагирующих веществ. Типы ОВР: Межмолекулярный. Окислитель и восстановитель находятся в разных веществах. Cu0+HN+5O3 àCu+2(NO3)2+N+4O2+H2O. Внутримолекулярные. Окислитель и восстановитель находятся в одном веществе: KCl+O2-2 àKCl-+O20. Диспропорционирования. Само вещество и окислитель и восстановитель: Cl20+KOHàKCl-+KCl+5O3+H2O.
2. Щёлочи – это растворимые основания. С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т.е. основные гидроксиды: NaOH → Na+ + OH- Более строгая формулировка: отщепляющие в качестве анионов (отрицательных ионов) только гидроксид-ионы. Растворы щелочей окрашивают индикатор фенолфталеин (сокращенно ф-ф) в малиновый цвет. Лакмус окрашивают в синий, метилоранж – в желтый, но это в школьной лаборатории видно плохо, не дает возможности отличить от нейтрального раствора. Щёлочи реагируют с кислотами с образованием соли и воды (реакция нейтрализации): NaOH + HCl = NaCl + H2O Щёлочи реагируют с кислотными оксидами с образованием соли и воды: 2NaOH + CO2 = Na2CO3 + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O (известковое тесто при неправильном хранении поглощает углекислый газ, образуется карбонат кальция) Щелочи реагируют с растворами солей, если в результате реакции образуется осадок: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)↓ Например, при сливании с растворимыми солями меди (II) выпадает синий осадок гидроксида меди (II). При нагревании солей аммония со щелочами выделяется газообразный аммиак: Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3↑ + 2H2O Получают путём электролиза хлоридов щелочных металлов или действием воды на оксиды щелочных металлов.
|
|
|
Билет 24. 1. Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец или ядер. Строение молекул бензола C6H6 SP2 – гибридизация 1200 – валентный угол  Гомологический ряд С6H6 – бензол С6H5 – CH3 – метилбензол С6H5 – C3H5 – этилбензол С6H5 – C3H7 – пропилбензол С6H5 – C4H9 – бутилбензол. Р-орбитали шести атомов углерода в бензоле, которые не участвуют в гибридизации, располагаются перпендикулярно к плоскости бензольного кольца и перекрываются друг с другом сверху и снизу. Электроны, находящиеся на этих орбиталях, образуют единую устойчивую п-электронную систему. Так возникает ароматическая связь. Физические свойства Бензол – бесцветная, нерастворимая в воде жидкость со своеобразным запахом. Его t кипения = 80,10 С. При охлаждении он легко застывает в белую кристаллическую массу с t плавления = 5,50 С. Химические свойства Реакции замещения Взаимодействие с галогенами C6H6 + Br2 à C6H5Br + HBr (в присутствии FeCl3) Взаимодействие с HNO3 C6H6 + HONO2 à C6H5NO2 + H2O (в присутствии H2SO4)нитробензол Реакции присоединения Гидрирование (присоединение Н2)
Гомологический ряд С6H6 – бензол С6H5 – CH3 – метилбензол С6H5 – C3H5 – этилбензол С6H5 – C3H7 – пропилбензол С6H5 – C4H9 – бутилбензол. Р-орбитали шести атомов углерода в бензоле, которые не участвуют в гибридизации, располагаются перпендикулярно к плоскости бензольного кольца и перекрываются друг с другом сверху и снизу. Электроны, находящиеся на этих орбиталях, образуют единую устойчивую п-электронную систему. Так возникает ароматическая связь. Физические свойства Бензол – бесцветная, нерастворимая в воде жидкость со своеобразным запахом. Его t кипения = 80,10 С. При охлаждении он легко застывает в белую кристаллическую массу с t плавления = 5,50 С. Химические свойства Реакции замещения Взаимодействие с галогенами C6H6 + Br2 à C6H5Br + HBr (в присутствии FeCl3) Взаимодействие с HNO3 C6H6 + HONO2 à C6H5NO2 + H2O (в присутствии H2SO4)нитробензол Реакции присоединения Гидрирование (присоединение Н2)
 + 3H2 à
+ 3H2 à 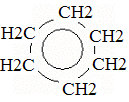 бензол циклогексан Присоединение галогенов
бензол циклогексан Присоединение галогенов  + 3Cl2 à
+ 3Cl2 à  (при температуре)бензол гексохлорциклогексан Реакции окисления Горение 2C6H6 + 15O2 à 12CO2 + 6H2O Бензол стоек к действию окислителей. Окисляются только гомологи по боковой цепи. C6H5 – CH3 + 3O à C6H5 – COOH + H2O (в присутствии KMnO4) бензойная кислота Получение Из циклогексана C6H12 à 3H2 + C6H6 (при t и катализаторе) циклогексан бензол Из гексана C6H14 à C6H6 + 4H2 (при t и катализаторе) Из ацетилена 3C2H2 à C6H6 (при t и катализаторе).
(при температуре)бензол гексохлорциклогексан Реакции окисления Горение 2C6H6 + 15O2 à 12CO2 + 6H2O Бензол стоек к действию окислителей. Окисляются только гомологи по боковой цепи. C6H5 – CH3 + 3O à C6H5 – COOH + H2O (в присутствии KMnO4) бензойная кислота Получение Из циклогексана C6H12 à 3H2 + C6H6 (при t и катализаторе) циклогексан бензол Из гексана C6H14 à C6H6 + 4H2 (при t и катализаторе) Из ацетилена 3C2H2 à C6H6 (при t и катализаторе).
|
|
|
2. Спирты́ (от лат. spiritus — дух; устар. алкого́ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H. Метано́л (метиловый спирт, древесный спирт[1], карбинол, метилгидрат, гидроксид метила) — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. В органической химии метанол используется в качестве растворителя. Метанол — бесцветная жидкость с запахом, напоминающим запах этилового спирта, но более слабым. Образование алкоголятов Спирты ведут себя как слабые кислоты, вступая в реакцию по связи O−H со щелочными и некоторыми другими металлами, и с сильными основаниями, например: 2 R−OH + 2 Na → 2 R−O−Na+ + H2↑ Вода имеет сравнимую с многими спиртами константу диссоциации кислоты, поэтому в реакции с сильными основаниями химическое равновесие, как правило, смещено влево (в сторону исходных продуктов): R−OH + NaOH ⇌ R−O-Na+ + H2O (равновесие смещено влево) Кислотность спиртов зависит от стабильности алкоксидного аниона R−O−. Электроноакцепторные группы, связанные с атомом углерода, несущим гидроксильную группу, стабилизируют этот анион и таким образом повышают кислотность, а электонодонорные уменьшают его стабильность, в результате повышается вероятность обратного присоединения протона и кислотность снижается. Гидроксильная группа – ОН является функциональной группой спиртов. Функциональными группами называются группы атомов, которые обуславливают характерные химические свойства данного класса веществ. Общая формула одноатомных спиртов: СnH2n + 1OH Физические свойства Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С12Н25ОН) – твёрдые вещества. Метанол, этанол, пропанол – бесцветные жидкости, растворимы в воде, имеют алкогольный запах. Метанол – сильный яд. Химические свойства Растворы спиртов имеют нейтральную реакцию на индикаторы; Взаимодействие с активными металлами 2C2H5OH + Na à 2C2H5ONa + H2 этанол этилат натрия Взаимодействие с галогеноводородными веществами C2H5OH + HCl àC2H5Cl + H2O хлорэтан Дегидратация C2H5OH à C2H4 + H2O (при t и в присутствии H2SO4) Взаимодействие с кислородом C2H5OH + 3O2 à 2CO2 + 3H2O Окисление 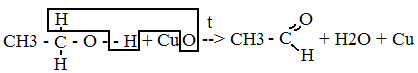 этанол уксусный альдегид Взаимодействие с карбоновыми кислотами
этанол уксусный альдегид Взаимодействие с карбоновыми кислотами 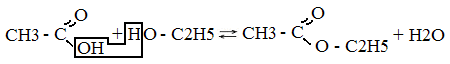 уксусная кислота | этиловый спирт | укс. этиловый эфир Получение спиртов Этанол получают из:Этилена C2H4 + HOH à C2H5OH (при катализаторе и t) Брожением глюкозы C6H12O6 à 2C2H5OH + 2CO2 Применение этанола: Получение уксусной кислоты, лекарства, фруктовых вод, духов и одеколонов, бутадиенового и бутадиен-стирольного каучука, горючего для двигателей, красителей, лаков и политур, растворителей, бездымного пороха.
уксусная кислота | этиловый спирт | укс. этиловый эфир Получение спиртов Этанол получают из:Этилена C2H4 + HOH à C2H5OH (при катализаторе и t) Брожением глюкозы C6H12O6 à 2C2H5OH + 2CO2 Применение этанола: Получение уксусной кислоты, лекарства, фруктовых вод, духов и одеколонов, бутадиенового и бутадиен-стирольного каучука, горючего для двигателей, красителей, лаков и политур, растворителей, бездымного пороха.
|
|
|
Билет 25. 1. NH3. Три атома водорода соединены с азотом ковалентными полярными связями (азот более электроотрицателен). В образовании связей принимают участие три неспаренных электрона азота и по одному электрону водорода. Молекула аммиака имеет форму треугольной пирамиды, в вершинах которой находятся атомы азота и водорода. Угол между связями N–H около 107оАммиак – бесцветный газ с характерным резким запахом. Легче воздуха, его можно собирать в перевернутые вверх дном сосуды. Аммиак хорошо растворяется в воде (в 1 литре воды при комнатной температуре растворяется около 700 литров аммиака). При повышенном давлении аммиак легко переходит в жидкое состояние. При последующем испарении поглощается много тепла, поэтому его используют в качестве хладагента в холодильных установках.Аммиак химически активен. Наличие у атома азота неподелённой электронной пары, не участвующей в образовании связей, делает возможным присоединение протона и образования еще одной, донорно-акцепторной связи, обозначаемой стрелкой:
H
l
[H – N → H ]+
l
H Ион аммония образуется, например, при растворении аммиака в воде:NH3 + H2O 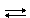 NH4+ + OH –Поэтому раствор аммиака обладает щелочными свойствами и окрашивает индикатор фенолфталеин в малиновый цвет.Аммиак взаимодействует с кислотами. Если близко поднести стеклянные палочки, смоченные концентрированным раствором аммиака и концентрированной соляной кислотой, образуется «дым» из кристалликов хлорида аммония:NH3 + HCl = NH4Cl Аммиак горит в кислороде с образованием молекулярного азота:4NH3 + 3O2 = 2N2 + 6H2OВ присутствии платины в качестве катализатора, азот в аммиаке окисляется до оксида азота (II):4NH3 + 5O2 = 4NO + 6H2O Эта реакция используется в производстве азотной кислоты и азотных удобрений. 10%-ный раствор аммиака в воде используется в медицине под названием «нашатырный спирт».При нагревании аммиак разлагается (реакция обратная синтезу):2NH3
NH4+ + OH –Поэтому раствор аммиака обладает щелочными свойствами и окрашивает индикатор фенолфталеин в малиновый цвет.Аммиак взаимодействует с кислотами. Если близко поднести стеклянные палочки, смоченные концентрированным раствором аммиака и концентрированной соляной кислотой, образуется «дым» из кристалликов хлорида аммония:NH3 + HCl = NH4Cl Аммиак горит в кислороде с образованием молекулярного азота:4NH3 + 3O2 = 2N2 + 6H2OВ присутствии платины в качестве катализатора, азот в аммиаке окисляется до оксида азота (II):4NH3 + 5O2 = 4NO + 6H2O Эта реакция используется в производстве азотной кислоты и азотных удобрений. 10%-ный раствор аммиака в воде используется в медицине под названием «нашатырный спирт».При нагревании аммиак разлагается (реакция обратная синтезу):2NH3 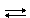 N2 + 3H2 Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй – свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной. Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) – акцептором электронной пары: H+ +:NH3 → NH4+ Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы. Чтобы подчеркнуть способ образования, донорно-акцепторную связь могут обозначать в структурных формулах стрелкой. Стрелку используют и чтобы изобразить смещение общей электронной пары в полярной связи (H→Cl), поэтому эти два случая не следует путать.
N2 + 3H2 Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй – свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной. Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) – акцептором электронной пары: H+ +:NH3 → NH4+ Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы. Чтобы подчеркнуть способ образования, донорно-акцепторную связь могут обозначать в структурных формулах стрелкой. Стрелку используют и чтобы изобразить смещение общей электронной пары в полярной связи (H→Cl), поэтому эти два случая не следует путать.
Билет 26. 1. Дисахариды представляют собой продукты, построенные из двух моносахаридов. Сахароза или свекловичный или тростниковый или просто сахар C12H22O11. Это бесцветное кристаллическое вещество, растворимое в воде. 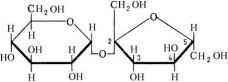 Она состоит из двух осадков моносахаридов: α-глюкозы и β-фруктозы. Они связаны за счёт гликозидного гидроксила(Гликозидная связь (англ. Glycosidic bond) — это тип ковалентной связи, которая соединяет молекулу сахара с другой молекулой, часто с другим сахаром. Гликозидная связь образуется между полуацетальной группой сахара (или производной сахара) и гидроксильной группой органического соединения, например, спирта.), поэтому остаток глюкозы находится только в циклической форме. В результате, сахароза не вступает в реакции, типичные для альдегидов. Характерным свойством сахарозы, и вообще всех сахаров, является способность их гидролизоваться в присутствии кислот с образованием двух моносахаров: C12H22O11+H2OàC6H12O6+C6H12O6 (глюкоза и фруктоза). В молекуле сахарозы имеется несколько гидроксильных групп. Поэтому соединение взаимодействует с гидроксидом меди (II) аналогично глицерину и глюкозе. При добавлении раствора сахарозы к осадку гидроксида меди (II) он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает гидроксид меди (II) до оксида меди (I). Сахароза является пищевым продуктом. В больших количествах её получают из сахарной свеклы и сахарного тростника.
Она состоит из двух осадков моносахаридов: α-глюкозы и β-фруктозы. Они связаны за счёт гликозидного гидроксила(Гликозидная связь (англ. Glycosidic bond) — это тип ковалентной связи, которая соединяет молекулу сахара с другой молекулой, часто с другим сахаром. Гликозидная связь образуется между полуацетальной группой сахара (или производной сахара) и гидроксильной группой органического соединения, например, спирта.), поэтому остаток глюкозы находится только в циклической форме. В результате, сахароза не вступает в реакции, типичные для альдегидов. Характерным свойством сахарозы, и вообще всех сахаров, является способность их гидролизоваться в присутствии кислот с образованием двух моносахаров: C12H22O11+H2OàC6H12O6+C6H12O6 (глюкоза и фруктоза). В молекуле сахарозы имеется несколько гидроксильных групп. Поэтому соединение взаимодействует с гидроксидом меди (II) аналогично глицерину и глюкозе. При добавлении раствора сахарозы к осадку гидроксида меди (II) он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает гидроксид меди (II) до оксида меди (I). Сахароза является пищевым продуктом. В больших количествах её получают из сахарной свеклы и сахарного тростника.
Билет 26. 1. Галогены- элементы главной подгруппы VII группы. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается. К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus. Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7. 2Al + 3F2 = 2AlF3, 2Fe + 3F2 = 2FeF3. Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например: Н2 + F2 = 2HF, Si + 2F2 = SiF4(г). При нагревании фтор окисляет все другие галогены по схеме Hal2 + F2 = 2НalF где Hal = Cl, Br, I, причем в соединениях HalF степени окисления хлора, брома и иода равны +1. Наконец, при облучении фтор реагирует даже с инертными газами: Хе + F2 = XeF2. Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер: 3F2 + ЗН2О = OF2↑ + 4HF + Н2О2. Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. 2Al + 3Cl2 = 2AlCl3(кр, 2Fe + ЗCl2 = 2FeCl3(кр), Si + 2Cl2 = SiCl4(Ж), Н2 + Cl2 = 2HCl(г). Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму: Cl2 + hν → 2Cl, Cl + Н2 → HCl + Н, Н + Cl2 → HCl + Cl, Cl + Н2 → HCl + Н и т. д. Возбуждение этой реакции происходит под действием фотонов (hν), которые вызывают диссоциацию молекул Cl2. Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами: СН3-СН3 + Cl2 → СН3-СН2Cl + HCl, СН2=СН2 + Cl2 → СН2Cl — СН2Cl. Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами: Cl2 + 2HBr = 2HCl + Br2, Cl2 + 2HI = 2HCl + I2, Cl2 + 2KBr = 2KCl + Br2, а также обратимо реагирует с водой: Cl2 + Н2О = HCl + HClO. Хлор может таким же образом реагировать (диспропорционировать) со щелочами: Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде), 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании). Для примера приведем реакции взаимодействия брома с кремнием и водородом: Si + 2Br2 = SiBr4(ж), Н2 + Br2 = 2HBr(г). Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов: I2 + I− → I−3. Образующийся раствор называется раствором Люголя.. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой: Н2 + I2 = 2HI.Астат реагирует с металлами (например с литием): 2Li + At2 = 2LiAt — астатид лития. С водородом, образуя астатоводород: H2 + At2 = 2HAt. Галогеноводоро́ды — общее название соединений, образованных из водорода и галогенов: Плавиковая кислота — водный раствор фтороводорода. Соляная кислота — водный раствор хлороводорода. Бромоводородная кислота — водный раствор бромоводорода. Иодоводородная кислота — водный раствор иодоводорода. Все галогеноводороды — бесцветные газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов. Галогеноводороды хлора, брома, йода при обычных условиях — газы. Хорошо растворимы в воде, при растворении протекают следующие процессы: НГ (г) + H2O (ж) → H3O+(р) + Г− (р). Галогены в галогеноводородах имеют степень окисления −1. Могут выступать в качестве восстановителей, причём восстановительная способность в ряду HCl — HBr — HI увеличивается: HF + H2SO4 ≠ реакция не идёт. HCl + H2SO4 ≠ реакция не идёт. 2HBr + H2SO4 = Br2 + SO2 + 2H2O. 8HI + H2SO4 = 4I2 + H2S + 4H2O. Иодоводород является сильным восстановителем и используется как восстановитель во многих органических синтезах. При стоянии, раствор HI вследствие постепенного окисления HI кислородом воздуха и выделения иода, принимает бурую окраску: 4HI + O2 → 2H2O + 2I2 Аналогичный процесс протекает и в водном растворе HBr, но намного медленнее. Растворы галогенов — сильные кислоты, в которых ион H+ выступает в качестве окислителя. Галогеноводородные кислоты реагируют с металлами, HI может реагировать даже с серебром. 2Ag + 4HI = 2H[AgI2] + H2 Фтороводород легко образует полимеры типа (HF)n
2. Фено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом гуаши. Обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия - C6H5ONa): C6H5OH + NaOH = C6H5ONa + H2O. Взаимодействие с металлическим натрием: 2C6H5OH + 2Na = 2C6H5ONa + H2↑. Взаимодействие с бромной водой (качественная реакция на фенол): C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6 трибромфенол. Взаимодействие с концентрированной азотной кислотой: C6H5OH + 3HNO3конц → C6H2(NO2)3OH + 3H2О образуется 2,4,6 тринитрофенол. Взаимодействие с хлоридом железа (III)(качественная реакция на фенол): 6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание). Реакция Кольбе — Шмидта или Кольбе процесс (названы в честь Адольфа Вильгельма Германа Кольбе и Рудольфа Шмитта) — химическая реакция карбоксилирования фенолята натрия действием диоксида углерода в жестких условиях (давление 100 атм., температура 125 °C) с последующей обработкой продукта кислотой. В промышленности эта реакции используется для синтеза салициловой кислоты. 
Билет 27. 1. Подгру́ппа азо́та, или пниктоге́ны (пникти́ды) — химические элементы 15-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы V группы). В группу входят азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл. 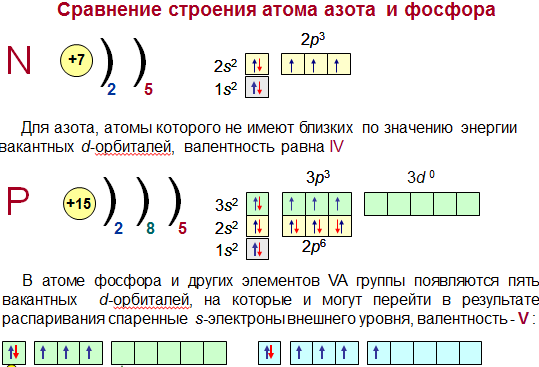
2. Природный каучук. Высокомолекулярный углеводород (C5H8)n, цис- полимер изопрена. Растворим в углеводородах и их производных (бензине, бензоле, хлороформе, сероуглероде и т. д.). В воде, спирте, ацетоне натуральный каучук практически не набухает и не растворяется. Уже при комнатной температуре натуральный каучук присоединяет кислород, происходит окислительная деструкция (старение каучука), при этом уменьшается его прочность и эластичность. При взаимодействии натурального каучука с серой, хлористой серой, органическими пероксидами (вулканизация) происходит соединение через атомы серы длинных макромолекулярных связей с образованием сетчатых структур. Это придает каучуку высокую эластичность в широком интервале температур. Натуральный каучук перерабатывают в резину. Первым синтетическим каучуком, имевшим промышленное значение, был полибутадиеновый (дивиниловый) каучук, производившийся синтезом по методу С. В. Лебедева (анионная полимеризация жидкого бутадиена в присутствии натрия), однако из-за невысоких механических качеств нашёл ограниченное применение. Изопреновые каучуки — синтетические каучуки, получаемые полимеризацией изопрена в присутствии катализаторов — металлического лития, перекисных соединений. В отличие от других синтетических каучуков изопреновые каучуки, подобно натуральному каучуку, обладают высокой клейкостью и незначительно уступают ему в эластичности. В настоящее время большая часть производимых каучуков является бутадиен-стирольными или бутадиен-стирол-акрилонитрильными сополимерами. Каучуки с гетероатомами в качестве заместителей или имеющими их в своём составе часто характеризуются высокой стойкостью к действию растворителей, топлив и масел, устойчивостью к действию солнечного света, но обладают худшими механическими свойствами. Наиболее массовым в производстве и применении каучуками с гетерозаместителями являются хлоропреновые каучуки (неопрен) — полимеры 2-хлорбутадиена. В ограниченном масштабе производятся и используются тиоколы — полисульфидные каучуки, получаемые поликонденсацией дигалогеналканов (1,2-дихлорэтана, 1,2-дихлорпропана) и полисульфидов щелочных металлов. Наиболее массовое применение каучуков — это производство резин для автомобильных, авиационных и велосипедных шин.
Билет 28. 1. Положение в периодической системе: железо находится в 4 периоде, побочной (Б) подгруппе VIII группы. Атомный номер железа 26. Схема расположения электронов по уровням:26Fe)))) 2 8 14 2 Чистое железо – мягкий металл. Железо способно намагничиваться в магнитном поле. Железо в химических реакциях окисляется до степени окисления +2 или +3. Со слабыми окислителями, такими как сера, разбавленные кислоты, растворы солей, – железо окисляется до +2 (валентность II). Если нагреть железные опилки с порошком серы, начинается экзотермическая реакция (с выделением теплоты), которая продолжается без дальнейшего нагревания. Образуется сульфид железа (II): Fe + S = FeS Железо находится в электрохимическом ряду напряжений левее водорода, поэтому вытесняет водород из кислот. При взаимодействии с соляной (хлороводородной) кислотой образуется хлорид железа (II): Fe + 2HCl = FeCl2 + H2↑ Железо вытесняет менее активные металлы (которые расположены правее в ряду напряжений) из растворов их солей. Если поместить железные опилки (или кнопку) в раствор хлорида меди (II), железо покрывается красным слоем меди, а голубой раствор приобретает зеленоватый цвет: Fe + CuCl2 = FeCl2 + Cu↓ Оксиды и гидроксиды железа нерастворимы в воде. Оксид железа (II) FeO, гидроксид железа (II) Fe(OH)2. Проявляют оснóвные свойства. Оксид железа (II) черного цвета. Гидроксид железа (II) выпадает в виде осадка зеленоватого цвета при добавлении щелочей в раствор соли железа (II). Железо горит в кислороде: 3Fe + 2O2 = Fe3O4 с образованием железной окалины (представляет из себя смешанный оксид Fe+2O•Fe2+3O3). Темно-серого цвета. Гидратированный оксид железа (III) Fe2O3• nH2O является основной составной частью ржавчины. Бурого цвета. Гидроксид железа (III) получают воздействием щелочей на соли железа трехвалентного. Железо широко применяется в промышленности в виде сплавов: чугуна и стали. Сплавы отличаются более высокой вердостью. В организме человека элемент железо входит в состав гемоглобина крови, осуществляющего транспорт кислорода из легких в ткани. распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо:Fe2O3+3H2à2Fe+3H2O (при 1000 градусов цельсия).
2. Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или водородным атомом.COH – карбоксильная группа.COOH – карбоксильная группа. Одноосновные (имеется одна карбоксильная группа). Физические свойства Низшие карбоновые кислоты – это жидкости с острым запахом, растворимы в воде. Высшие карбоновые кислоты – твёрдые вещества без запаха, не растворимы в воде. Химические свойства Диссоциация CH3COOH 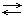 CH3COO-- + H+ Взаимодействие с металлами 2CH3COOH + Mg à (CH3 – CO)2Mg + H2 С основными и амфотерными оксидами CH3COOH + MgO à (CH3 – COO)2Mg + H2O С гидроксидами CH3COOH + NaOH à CH3 – COONa + H2O С солями более слабых и летучих кислот 2CH3COOH + CaCO3 à (CH3COO)2Ca + H2CO3 (разлагается на H2O и CO2) Получение ангидрида
CH3COO-- + H+ Взаимодействие с металлами 2CH3COOH + Mg à (CH3 – CO)2Mg + H2 С основными и амфотерными оксидами CH3COOH + MgO à (CH3 – COO)2Mg + H2O С гидроксидами CH3COOH + NaOH à CH3 – COONa + H2O С солями более слабых и летучих кислот 2CH3COOH + CaCO3 à (CH3COO)2Ca + H2CO3 (разлагается на H2O и CO2) Получение ангидрида  ангидрит укс. Кислоты Со спиртами CH3
ангидрит укс. Кислоты Со спиртами CH3  + HO – C5H11
+ HO – C5H11 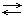
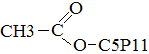 + H2O Уксусно-пентиловый эфир. Получение Окисление алканов 2CH4 + 3O2 à 2H
+ H2O Уксусно-пентиловый эфир. Получение Окисление алканов 2CH4 + 3O2 à 2H  + H2O (при t и катализаторе) Окисление спиртов C2H5OH + O2 à CH3
+ H2O (при t и катализаторе) Окисление спиртов C2H5OH + O2 à CH3  + H2O (при t и катализаторе) Окисление альдегидов 2CH3
+ H2O (при t и катализаторе) Окисление альдегидов 2CH3  + O2 à 2CH3
+ O2 à 2CH3  Применение уксусной кислоты:
Применение уксусной кислоты:
Получение лекарств, ацетатного шёлка, солей, фруктовых эссенций, растворителей для лаков, киноплёнки, красителей для тканей, стимуляторов роста растений.
Билет 29. 1. Хром — элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. твёрдый металл голубовато-белого цвета. Для хрома характерны степени окисления +2, +3 и +6. (см. табл.) Практически все соединения хрома окрашены. Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»): 2Cr3+ + Zn = 2Cr2+ + Zn2+ Оксид CrO получают термическим разложением карбонила хрома Cr(СО)6. Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II). Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+ до зелёного (в координационной сфере присутствуют анионы). Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов) Гидроксид хрома (III) получают, дейсвуя аммиаком на растворы солей хрома (III): Cr3+ + 3NH3 + 3H2O = Cr(OH)3 + 3NH4+ Можно использовать растворы щелочей, но в их избытке образуется гидроксокомплекс: Cr3+ + 3OH- = Cr(OH)3 Cr3+ + 4OH- = [Cr(OH)4]- Сплавляя Cr2O3 со щелочами получают хромиты: Cr2O3 + 2NaOH → 2NaCrO2 + H2O. Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах: Cr2O3 + 6HCl → 2CrCl3 + 3Н2О. При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI): 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O. То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (сплав при этом желтеет): 2Cr2O3 + 8NaOH + 3O2 = 4Na2CrO4 + 4H2O При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью. Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 (красный). Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 2106; Нарушение авторских прав?; Мы поможем в написании вашей работы!