
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура. Факторы, влияющие на скорость химических реакций
|
|
|
|
Факторы, влияющие на скорость химических реакций. Реакционный механизм. Переходное состояние промежуточная частица, промежуточное соединение.
Раздел химии, изучающий скорость химических реакций называется химической кинетикой.
Скорость химической реакции – число элементарных актов реакции, происходящих в единицу времени, в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций) раздела фаз. Мерой скорости хим. реакции называется количество вещества, вступившего в реакцию или образовавшегося при реакции за единицу времени в единице объема системы (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенной реакции).
V, моль·л/с
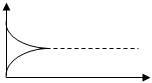 |
Vпрям
Vпрям=Vобратн
Vобратн
T, сек
Факторы влияющие на скорость хим реакции:
Правило Вант-Гоффа: при повышении t на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза.
Vt2=Vt1*γt1-t2/10 где γ – температурный коэффициент реакции.
2.Концентрация реаг.в-тв. (чем больше скорость х.р.,тембольше концентрация).
3.Площадь соприкасновения( только для тв.в-тв)чем больше площадь,тем быстрее идёт р-я.
4.Природы реагир.веществ.
5. Катализаторов – вещество, не расходующееся в результате протекания реакции, но ускоряющее р-ю.Ингибиторов-замедляющих.Промоторы-катализатор катализатора.
Зависимость скорости химической реакции от катализатора – катализатор снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, и эти стадии энергетически более доступны.
Бывают катализаторы как ускоряющие протекание реакции, так и замедляющие ее. В первом случае катализ называется положительным, а во втором - отрицательным.
|
|
|
Реакционный механизм- 
ПЕРЕХОДНОЕ СОСТОЯНИЕ (активированный комплекс), конфигурация системы атомных ядер и электронов, участвующих в элементарном акте химической реакции, в момент преодоления системой энергетического барьера, разделяющего ее начальное и конечное состояния. Теорию переходного состояния применяют для расчета скоростей химических реакций.
Промежуточная частица-
Промежут.соединение-
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 370; Нарушение авторских прав?; Мы поможем в написании вашей работы!