
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Декарбоксилирование пировиноградной к-ты
Реакция окислительного декарбоксилирования карбоновых кислот заключается в отщеплении от молекулы карбоновой кислоты карбоксильной группы при нагревании до 260—300С, в присутствии окислителя и хлорид-анионов. В результате окислительного декарбоксилирования пирувата образуются ацетил- КоА, восстановленный НАД и диоксид углерода:
Эта схема представляет собой суммарный результат многостадийного процесса, который катализируется сложной ферментной системой — пируватдегидро- геназным комплексом. Комплекс содержит три фермента: пируватдекарбоксила зу, ацетилтрансферазу и дегидрогеназу дигидролипоевой кислоты. Кроме того, в реакциях участвуют пять коферментов: НАД, ФАД, тиаминдифосфат, липоевая кислота и кофермент А (КоА). Первую реакцию процесса катализирует пируватдекарбоксилаза (Е1, рис. 8.8). В результате действия пируватдекар боксилазы (Е1) от пировиноградной кислоты отщепляется карбоксильная группа, а ацетильный остаток присоединяется к атому серы липоевой кислоты, т. е. получается ацетиллипоат-Е2.Декарбоксилирование пирувата происходит при прямом участии тиаминди фосфата (производное витамина В2): в ходе реакции к атому углерода тиазолового кольца. Второй фермент комплекса — дигидролипоат-ацетилтрансфераза — катализирует перенос ацетильного остатка, соединенного с его (фермента 2) собственной простетической группой, на КоА; при этом получаются дигидролипоевая кислота (в составе ацетилтрансферазы) и ацетил-КоА. Третий фермент — дегидрогеназа дигидролипоевой кислоты (ЕЗ). Акцептором водорода в реакции служит НАД. В результате дегидрирования дигидролипоевая кислота превращается в начальную форму — дегидролипоевую кислоту, и пируватдегидрогеназный комплекс может реагировать с очередной молекулой пирувата. Дигидролипоилдегидрогеназа содержит в качестве кофермента ФАД, который служит промежуточным акцептором водорода.Таким образом, в окислительном декарбоксилировании пирувата участвует пять коферментов. Три из них — тиаминпирофосфат, липоевая кислота и ФАД — прочно связаны с ферментами комплекса, а два других — КоА и НАД — находятся в свободно растворенном состоянии и служат акцепторами главных конечных продуктов — ацетильного остатка и атомов водорода. Ацетильный остаток затем окисляется в цитратном цикле, а водород с НАДН поступает в цепь переноса электронов и протонов.
36.Цикл Кребса. Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. цикл Кребса – общий конечный путь окисления ацетильных групп, в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций. Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла 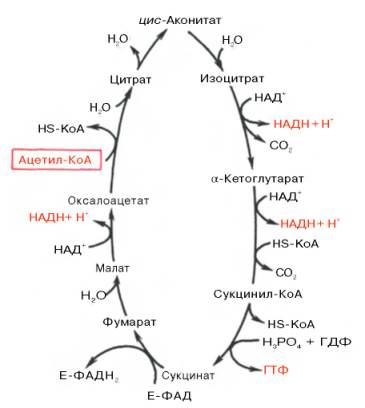 одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота. В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата. Третья реакция. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы. В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+. Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинилКоА. В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат.
одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота. В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата. Третья реакция. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы. В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+. Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинилКоА. В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат.
За один оборот цикла происходит полное окисление одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий.
37. Переваривание, всасывание липидов.
С пищей в организм ежедневно поступает от 80 до 150 г липидов. Основную массу составляют жиры, наряду с глюкозой служащие главными источниками энергии. При рациональном питании жиры обеспечивают не более 30% от общего количества калорий, поступающих с пищей. Жидкие жиры (масла) содержат в своём составе полиеновые жирные кислоты, которые не синтезируются в организме; поэтому жидкие жиры должны составлять не менее одной трети жиров пищи. С липидами в организм поступают и жирорастворимые витамины A, D, Е, К. Переваривание липидов пищи происходит в кишечнике. Основные продукты гидролиза (жирные кислоты и 2-моноацилглицеролы) после всасывания подвергаются ресинтезу и последующей упаковке в хиломикроны (ХМ) в клетках слизистой оболочки кишечника. Желчные кислоты играют важную роль в переваривании и всасывании липидов. В тонкой кишке конъюгированные желчные кислоты, являясь поверхностно-активными веществами, адсорбируются в присутствии свободных жирных кислот и моноглицеридов на поверхности капелек жира, образуя при этом тончайшую пленку, препятствующую слиянию мельчайших капелек жира в более крупные. При этом происходит резкое снижение поверхностного натяжения на границе двух фаз - воды и жира, что приводит к образованию. Образование таких растворов облегчает действие панкреатической липазы, которая при воздействии на жиры расщепляет их на глицерин, легко всасывающийся кишечной стенкой, и жирные кислоты, нерастворимые в воде. Желчные кислоты, соединяясь с последними, образуют холеиновые кислоты, хорошо растворимые в воде и поэтому легко всасывающиеся кишечными ворсинками в верхних отделах тонкой кишки. Вторая существенная роль желчных кислот - регуляция синтеза холестерина и его деградации. Скорость синтеза холестерина в тонкой кишке зависит от концентрации желчных кислот в просвете кишки. Основная часть холестерина в организме человека образуется путем синтеза, а незначительная часть поступает с пищей. Таким образом, влияние желчных кислот на обмен холестерина заключается в поддержании его баланса в организме. Желчные кислоты сводят к минимуму нарастание или недостаток холестерина в организме.
39. Биосинтез липидов.
Биосинтез жирных кислот заключается в постепенном удлинении цепи жирной кислоты на два углеродных атома (по аналогу с b -окислением).Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил–КоА (присоединение активированной углекислоты) с образованием малонил–КоА. Биосинтез идет с участием мультиферментного комплекса – синтетазы жирных кислот, состоящей из 7 ферментов, связанных с ацилпереносящим белком (АПБ). Синтез начинается с присоединения ацетил–КоА и малонил–КоА к синтетазе с участием АПБ и образованием соответственно ацетил – АПБ и малонил –АПБ. Далее к ацетил–АПБ присоединяется двууглеродный фрагмент от малонил–АПБ с отщеплением углекислого газа. Образовавшийся продукт проходит через все ферменты синтетазы и в результате за один цикл реакций молекула жирной кислоты удлиняется на два углеродных атома. Образованная жирная кислота, не отщепляясь от АПБ, включается в следующий цикл синтеза, который также начинается с присоединения молекулы малонил–АПБ к карбоксильному концу растущей цепи жирной кислоты. Несколько циклов биосинтеза приводят к образованию молекулы необходимой жирной кислоты.По сравнению с b-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; в качестве доноров двууглеродных фрагментов при биосинтезе используется не ацетил –КоА, а малонил АПБ; в качестве восстановителя выступает НАДФ.Биосинтез триацилглицеридов.Первичный биосинтез триацилглицеридов начинается в стенках кишечника из продуктов распада липидов по b - моноглицеридному пути: из жирных кислот образуется их активная форма – ацил –КоА и затем происходит ацилирование b - моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров, с образованием сначала диглицеридов, а затем триглицеридов:b - моноглицерид R – СО – S-КоА => Диглицерид + НS –КоА; Диглицерид + R1 – СО – S-КоА =>Триглицерид + НS –КоА. Все реакции катализируются ферментным комплексом – триацилглицеридсинтетазой.В тканях биосинтез триглицеридов протекает через образование a - глицерофосфата (глицерол – 3-фосфата) как промежуточного соединения и включает следующие реакции: Образование активной формы жирной кислоты – ацил–КоА при участии ацил-КоА-синтетазы; Образование a - глицерофосфата (глицерол – 3-фосфата) при участии глицеролкиназы; Превращение a - глицерофосфата в фосфатидную кислоту при участии глицерофосфат–ацилтрансферазы в результате ацилирования двумя молекулами ацил-КоА; Превращение фосфатидной кислоты путем гидролиза в диглицерид при участии фосфатидат-фосфогидролазы; Ацилирование диглицерида с образованием триглицерида при участии диглицеридацилтрансферазы.
40. Регуляция липидного обмена.
Липиды выполняют множествофункций. Несомненно интенсивность и направленность различных превращений липидов должны соответствовать потребности организма в энергетическом и пластическом материале. Поэтому крайне важны проблемы регуляции.В ходе мобилизации образуются вжк и глицерол, которые постпают из липоцитов вначале в кровь, а затем в клетки с выделением необходимой клеткам энергии. Этот процесс мобилизации резервных тригяицеридов получил название - липолиз. Он контролируется целым рядом гормонов. К числу их относиться адреналин, норадреналин, глюкагон, соматотропин, кортизол, тироксин, тестостерон. Они стимулируют липолиз.Несомненно есть гормоны стимулирующие процесс липогенеза - инсулин и эстроген. Многие из названных гормонов являются активаторами гормончувствительной липазы лнпоцитов (триацилглицерид-липаза). Адреналин взаимодействует со своим рецептором на наружной мембране липоцита с образованием гормон-рецептурного комплекса.В ответ на образование гормон-рецепторного комплекса с помощью специального механизма происходит активаци расположенной па внутренней поверхности аденчлатцнклазы. Пока нет гормона аденилатциклаза не активна, не работает. Изменение ее конформации приводит к активации и этот фермент начинает синтезировать из АТФ циклическую АМФ (месенджер). Сам гормон не проникает в клетку.Увеличение внутриклеточной концентрации циклической АМФ активирует фермент протеннкиназу.Этот фермент активирует триацилглщеролмпазу путем ее фосфорилирования т.е. так называемой ковалентной модификацией. Триацилглицероллипаза активна только в фосфорилированной форме. Активация фермента приводит к усилению гидролиза резервных триглицерпдов и к. увеличению выброса влек и глицерола из липоцита в русло крови. Регуляция пируватдегидрогиназного комплекса, ацетилКоА-карбоксилазы и глицеролфосфатацилтрансферазы осуществляется путем координированного процесса ковалентной модификации, этих ферментов: фосфорилирование - дефосфорилирование. В целом воздействие инсулина на липоциты приводит во-первых к торможению липолиза в клетках во-вторых активации липогенеза Тем самым способствует накоплению энергетических резервов в организме в виде триацилглиуеринов. Механизм действия эстрогенов и их вляние на липогенез пока еще не изучен окончательно.
41. Нарушение липидного обмена.
Нарушение липидного обмена выявляется у людей самыми различными заболеваниями. Эти нарушения можно разделить на первичные и вторичные. При первичных или наследственных нарушениях липидного обмена патологические состояния возникают как следствие генетического дефекта, который сопровождается нарушением синтеза белковых молекул имеющих то или иное отношение к обмену липидов. во-первых это может быть нарушение синтеза белков-рецепторов для ливп во-вторых это может быть нарушение синтеза апопротеинов в-третьнх нарушение синтеза ферментов катализирующих отдельные реакции липидного обмена. Вторичные нарушения липидного обмена развиваются или в результате имеющегося заболевания, как следствие (сахарный диабет) или как следствие воздействия факторов внешней среды включая сюда и нарушение поведенческих реакций. Первичные нарушения обмена липидов. К наследственным заболеваниям сопровождающимся нарушением обмена липидов относится: 1. гиперхиломикронемия, 2. семейная гиперхолистеринемия 3. болезнь Нимона-Пика 4. болезнь Тея-Сакса. Наследственная гиперхиломикронемия. Болезнь Нимона-Пика В клетках больного отсутствует фермент лизосом - сфингомиелиназа. Или же активность его значительно снижена. Понятно, что в лизосомах накапливается сфингомиелин (т.е.речь идет о типичной болезни накопления). Поражается селезенка, печень, мозг, почки и др. Органы. Для больных характерно задержка физического и умственного развития, нарушение функций различных органов и в последствии ранняя смерть, обычно в детском возрасте. Болезнь Тея-Сакса. Наследственное нарушение обмена сфиигопипидов. У больных нарушен синтез одного из ферментов расщепляющих ганглиозиды. Особенно много ганглиозидов накапливается в лизосомных клетках головного мозга. Для этих больных так же характерна задержка физического и умственного развития, ранняя смерть. Специфическим признаком этого заболевания является ранняя слепота. Частота врожденных нарушений обмена липидов широко варьирует. Семейная гиперхолистериноемия встречается с частотой 1 на 200 детей. Болезнь Тея-Сакса 1 на 300 родившихся.
42. Протеолиз. Распад белков происходит при участии протеолитических ферментов, расщепляющих пептидные связи. Переваривание белков начинается в желудке под влиянием ферментов желудочного сока. Основным ферментом желудочного сока является пепсин, который выделяется в неактивной форме в виде пепсиногена. Пепсиноген активируется соляной кислотой. Оптимум рН для пепсина лежит в пределах 1,5—2. В результате каталитического действия пепсина в желудке образуются пептоны, построенные из достаточно длинных полипептидов. Расщепление под влиянием пепсина может сопровождаться также появлением свободных аминокислот. Пептоны и нерасщепленные белки поступают в кишечник, где подвергаются действию ферментов поджелудочной железы (трипсина и химотрипсина), относящихся, как и пепсин, к протеиназам. Трипсин выделяется соком поджелудочной железы в неактивной форме, в виде трипсиногена. Последний активируется ферментом эктерокиназой кишечного сока. Оптимум рН для трипсина равен 7—8. Неактивной формой химотрипсина является химотрипсиноген, который активируется трипсином. Полипептиды, три- и дипептиды, образовавшиеся в результате действия на белки пепсина, трипсина, химотрипсина, подвергаются дальнейшему расщеплению в кишечнике под влиянием ферментов кишечного сока — пептидаз (карбоксипептидазы, аминопептидазы, дипептидаз). В результате последовательного действия всех вышеперечисленных ферментов пищеварительного тракта белковые вещества распадаются до аминокислот, которые всасываются в кровь через стенку кишечника.
44. Метаболизм безазотистых комнпонентов.
Углеродные скелеты аминокислот, образующиеся при дезаминировании аминокислот могут использоваться в клетках по различным направлениям: 1) Они могут использоваться в качестве субстратов для глюконеогенеза (синтез глбкозы из иеуглеводных предшественников); 2) Превращение углеродных скелетов в ацетоновые тела;
3) Окисление до углекислого газа и воды; 4)Использование углеродного скелета для ресинтеза аминокислот.
Углеродные остовы аминокислот серина, глицина, треонина, цистиина, аланина превращаются в пируват, далее карбоксилируются с образованием оксалоацетата. Углеродные скелеты аспартата и аспаргина за счет дезаминирования превращаются в ЩУК. Пролин, гистидин, глютомат, глютамин, валин, изолейцин, метионин превращаются в промежуточные продукты цикла Кребса и то же могут превращаться в оксалоацетат. В связи с обратимостью реакций гликолиза из него могут, при наличии энергии, синтезироваться молекулы глюкозы, поэтому эти аминокислоты получили название гликогенных или глюкопластических. Аминокислота, которая при распаде дает любое промежуточное соединение гликолиэа или цикла Кребса может использоваться в клетке для синтеза гаюкозы. Глюкозы мы синтезируем в сутки до 120 грамм - это интенсивный синтез, причем синтез идет в основном за счет углеродного скелета аминокислот. Лейцин, лезин, тирозин, фенилаланнн и триптофан (в качестве промежуточного продукта их распада образуется ацетоацетат) получили название кетопластических или кетогенных. Хотя следует отметить, что часть углеродного скелета фенилаланина и тирозина превращается в фумаровую кислоту и может использоваться для синтеза глюкозы, т е эти аминокислоты (их скелеты) являются аминокислотами со смешанными функциями, часть может давать глюкозу, часть ацетоновые тела
По сути кетоппастическими являются лейцин, лизин, триптофан. Углеродные остовы как глюко-, так и кетопластических аминокислот могут окисляться до углекислого газа и воды в цикле Кребса. Поскольку ацетоацетат в клетках перефирических тканей активируется образованием ацетоацетилКоА, который затем дает 2 молекулы ацетилКо, которые вовлекаются в цикл Кребса, где и происходит их дальнейшее превращение.
Оксалоацетат, образующийся из углеродных скелетов ряда аминокислот, при своем декарбоксилировании превращается в пируват, а пируват в свою очередь декарбоксилируясь дает ацетилКоА. АцетилКоА в независимости от пути его образования будет поступать в цикл Кребса и окисляться до конечных продуктов.
Следует отметить, что избыток ацетилКоА может быть использован на синтез высших жирных кислот, т е если мы будем есть белки в больших количествах и не шевелиться, то это не значит что мы будем очень стройными, поскольку аминокислоты превращаются в жиры.
45. Токсичнсть аммиака и его обезвреживание.
В организме человека аммиак образуется, во-первых в результате дезаминирования аминокислот во-вторых в результате инактивации путем окисления биогенных аминов в-третьих в результате распада азотистых оснований некоторых нуклеотидов в-четвертых определенное количество аммиака постоянно образуется в кишечнике в качестве продукта жизнедеятельности микробной микрофлоры (при гниении белков в кишечнике). Ежесуточно в организме человека образуется от 15 до 17 грамм аммиака. Аммиак представляет собой высокотоксичное соединение. Его концентрация в крови составляет в среднем величину 0,1-0 Д мг/л. При повышении концентрации в крови выше 1 мг/л наблюдаются симптомы аммиачного отравления.
Почему происходит отравление? Это связано с блокировкой работы цикла Кребса. Дело в том, что аммиак идет на восстановительное аминироваиие а-кетоглютаровон кислоты и этот промежуточный продукт постоянно изымается из цикла Кребса. Симптомы аммиачного отравления. 1 Трема (дрожание) 2 Повышенная раздражительность 3 Нечленораздельная речь 4 Затуманивание зрения 5 В тяжелых случаях кома 6 Смерть. Основным органом где происходит обезвреживание аммиака является несомненно печень. В ее гепатоцитах до 90% образовавшегося аммиака превращается в мочевину, которая с током крови поступает из печени в почки и затем выводиться с мочой. В норме в сутки с мочой выводиться 20-35 гр мочевины. Небольшая часть образующегося в организме аммиака (примерно 1гр в сутки) выводится почками с мочой в виде аммонийных солей. Аммиак образуется везде. Аммиак, образующийся в клетках различных органов и тканей, в свободном состоянии не может переноситься с кровью к печени или к почкам. В виду его высокой токсичности он транспортируется в эти органы в связанной форме в виде нескольких соединений, но преимущественно в виде аминов дикарбоновых кислот, а именно глютамина и аспаргина. Наибольшую роль в системе безопасного транспорта аммиака играет глютамин. Он образуется в клетках периферических органов и тканей из аммиака и глутомата в энергозависимой реакции катализируемой ферментом глутаминсинтетазой. В виде глутамина аммиак переносится в печень или в почки, где расщепляется до аммиака и глутомата в реакции катализируемой глутаминазой. Требуется энергия АТФ. Концентрация глутомина в крови на несколько порядков выше, чем других аминокислот. Меньшее значение имеет аналогичная система безопасного транспорта с участием аспаргина. Аммиак связывается в виде аспаргина. Доставляется в печень или в почки где с участием аспарокнназы происходит выделение свободного аммиака. Есть еще один путь безопасного транспорта. Аммиак из мышц в печень транспортируется с участием аданина, который образуется в мышечной ткани из аммиака к пирувата. В гепатоцитах аланин вновь расщепляется на аммиак и пируват. Нарушение процессов обезвреживания аммиака приводит к его накоплению в крови. Развивается состояние - гипераммониемия. Токсичность аммиака объясняется его способностью связывать в клетках а-кетоглуторат за счет обратимости действия фермента глутоматдегидрогеназы. В митохондриях резко падает концентрация а-кетоглутората, что приводит к нарушению работы цикла Кребса и развитию тяжелейшего гипоэнергетического состояния вплоть до летального исхода. Гипераммонеикия может быть: Первичной. В этом случае ее развитие обуславливается врожденной недостаточностью одного из ферментов мочевинообразования. Для облегчения состояния таких больных им необходимо уменьшать содержание белка в пищевом рационе. Вторичной. Встречается при тяжелых поражениях печени, хотя необходимо отметить, что печень обладает большими резервными возможностями в обезвреживании аммиака. Сохранение всего 1/6 части неповрежденной печеночной ткани может полностью обеспечивать обезвреживание аммиака.
46. Биосинтез аминокислот.
Получение аминокислот в промышленныз условиях осуществляется с помощью химического или микробиологического метода. Химический синтез многовариантен, но во всех случаях связан с получением рацемических смесей, которые необходимо разделять на активные стереоизомеры. В кач-ве примера можно привести получения L-метионина из бетта-метилтиопропионового альдигида, который в свою очередь синтезируется из акролеина и метилмеркоптана: СН3SH+акролеин=>бетта-метилтиопропионовый альдигид => кат.(НСN) циангидрид => кат.(NH2CONH2) гидантион D, L-метионина => (гидролиз) D, L-метионин. Ферментативный синтез. В результате него образуются в основном L-аминокислоты. Фумаровая кислота + NH3 => (аспартаза) L-аспаргиновая кислота. Микробиологический синтез. Используют мутанты микроорганизмов, которые утратили некоторые ферменты синтеза одних аминокислот, но преобрели способность интенсивно синтезировать другие. Одной из первых аминокислот, полученных методом микробиологического синтеза, была L-глутоминовая кислота. Этим способом можно получать также ароматические аминокислоты, например триптофан.
47. Нарушение белкового обмена. Для оценки состояния белкового обмена исползуется информация, полученная при определении белковых компонентов плазмы крови. Они делятся на альбумины (40-50г/л) это самые легкие белки, содержание их в сыворотке крови менее 300 г/л приводит к возникнованию отеков, они переносят различные лкарственные в-ва а так же анионы и катионы, глобулины (20-30 г/л) бывают разных видов: альфа1, альфа2, бетта и гамма, они нетерогенны, альфа и бетта глобулиновые фракции содержат липо- и гликопротеины, а так же белки связанные с металлами, гамма-глобулиновая фркция состоит из гликопротеинов, является антителами, фибриногены (2-4 г/л).Важным показателем является соотношение альбуминов и глобулинов. (а/г). В норме ихэтот коэфициент равен 1,3-2,0. Наблюдаются отклонения такие как: Гиперпротеиннемия, Абсолютная гиперпротеинемия, гипопротеинемия. Гиперпротеинемия – увеличение общего содержания белков. Различают относительную и абсолюбную. Чаще встречается первая из-за потери воды организмом, а, значит, увеличением концентрации белков. Проявляется как диарея у детей, рвота при непроходимости верхней части тонкой кишки, обширные ожоги. Абсолютная гиперпротеинемия – встречается редко. Развивается из-за увеличения синтеза глобулинов, напрмиер, при инфекции и миеломной болезни. В сыворотке крови таких больных появляются специфические белки, не существующие в нормальных условиях. Такое состояние называется парапротеинемия. Гипопротеинемия – уменьшение общего количесва белка в плазме крови. Выраженная гипопротеинемия – постоянный симптом нефротического синдрома, а также наболюдается при поражении печеночных клеток (токсический гепетит). При многих заболеваниях также изменяется число отдельных белковых фракций, хотя общее число белков остается в норме. Такое заболевание носит название диспротеинемия.




|
|
Дата добавления: 2015-04-23; Просмотров: 2442; Нарушение авторских прав?; Мы поможем в написании вашей работы!