
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов. Гальванические элементы. 1.если опустить металлическую пластину в воду, то ионы поверхностного слоя под действием полярных молекул воды отрываются и переходят в раствор в
|
|
|
|
9.
1. если опустить металлическую пластину в воду, то ионы поверхностного слоя под действием полярных молекул воды отрываются и переходят в раствор в гидротированном виде. 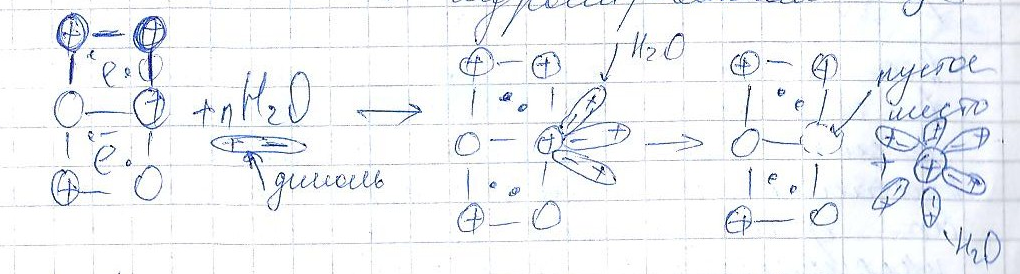
В результате пластина заряжается «-», а раствор «+».
Ионы металла, перешедшие в раствор, элекростатически притягиваются к «-» заряженной пластине. И на границе металл-электролит возникает двойной электрический слой.

Он характеризуется скачком потенциалов, которые называются электродным потенциалом металла. 
Когда двойной электрический слой станет плотным и насыщенным часть ионов вновь возвращается на пластину, тем самым устанавливается динамическое равновесие.
Meo+mH2O =(обратим.) Me(H2O)n+m+ne-
Потенциал металла, устанавливающийся в момент динамического равновесия между пластиной и раствором называется равновесным потенциалом металла.
Св-ва металлов посылать свои ионы в раствор Нернст назвал электролитической упругостью растворения.
Обратный процесс перехода ионов из раствора на пластину называется ионным осматическим давлением.
2. Гальванические элементы- это устройство, в которых химическая энергия ОВР превращается в электростатическую.
Гальванический элемент Якоби-Даниэля состоит из 2х полуэлементов:
Zn пластины в растворе ZnSO4 и Cu в растворе CuSO4
Пластины соединяют проводником 1го рода через гальвонометр.
Для возникновения электрического тока необходимо соединить растворы проводником 2го рода.
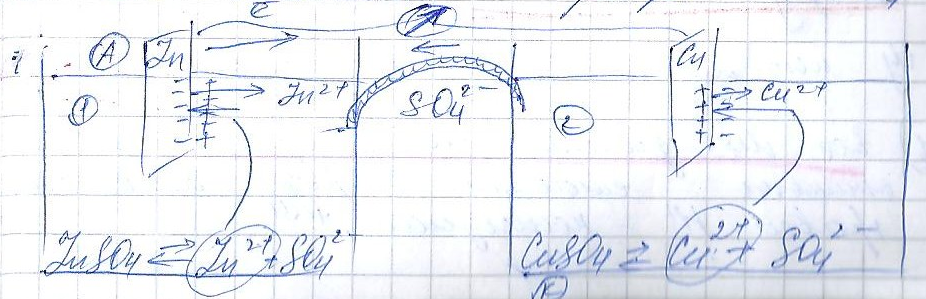
Он обладает ионной проводимостью, по нему сульфат ионы движутся из раствора 2 в 1.
Внутренняя цепь замыкается, внутри появляется электрический ток.
Электрод, на котором происходит процесс окисления, называется анодом.
Электрод, на котором восстановление-катодом.
|
|
|
Ур-ия тока образующей реакции в молекулярном виде и ионном:
Zno+Cu2+ Zn2++Cuo
Zno+CuSo4 ZnSo4+Cuo
Схема работы гальванического элемента:
Zno/ Zn2+// Cu2+/ Cuo
Zno / ZnSo4// CuSo4 / Cuo
Эдс- это главная характеристика работы ГЭ, представляющая разницу между потенциалом анода и катода
ЭДС= Еко - Еао
3. коррозия металлов- самопроизвольный окислительно-восстановительный процесс разрушения металла, протекающий на границе металл -окружающая среда.
4. химическая коррозия - это процесс разрушения металла под воздействием окружающей среды не электролита, без возникновения эл. тока.
Она делится на:
· Газовую- протекающую под воздействием окислителей при высокой температуре.
4Fe + 6Н2О + ЗО2 = 4Fe(OH)3
4Fe + 3O2 → 2Fe2O3
2Al + 3H20 = Al2O3 + 3H2.
· Жидкостную
Коррозия бензобаков, нефтехимического оборудования
7. Электрохимическая коррозия -это процесс разрушения металла под воздействием агрессивной среды электролита с образованием в системе эл. тока.
Она протекает по типу на короткозамкнутых микрогальванических эл-тов. Причиной возникновения ГЭ является наличие примесей в металле.
Сущность: более активный металл является анодом и разрушается, катодом является менее активный метал или примесь неметалла.
Отрицательная роль - это разрушение любого материала, будь то металл или керамика, дерево или полимер.
Пример:
Схема коррозии углеродной стали в нейтральной среде
 при переходе температур на пов-ть стали конденсируются капельки влаги.
при переходе температур на пов-ть стали конденсируются капельки влаги. 
избыточные электроны с анодных участков переходят на катодные увеличивая «-» заряд катода и вызывает его поляризацию.
Молекулы кислорода, содержащиеся в нейтральной среде, подходят к катоду, принимая эти избыточные электроны.
Ионы кислорода неустойчивы и взаимодействуя с молекулами воды, образуют щелочную среду.
А:(Fe): 2Feo-2*2e 2Fe2+
К:(C, Fe3C): O2+4e 2O2-
2O2-=2H2O 4OH-
Вторичный процесс: 2Fe2-+4OH- 2Fe(OH)2 (осадок)
|
|
|

Рассмотрим коррозию в кислой среде сплава железа с никелем.
Деполяризатор- катионы водорода.
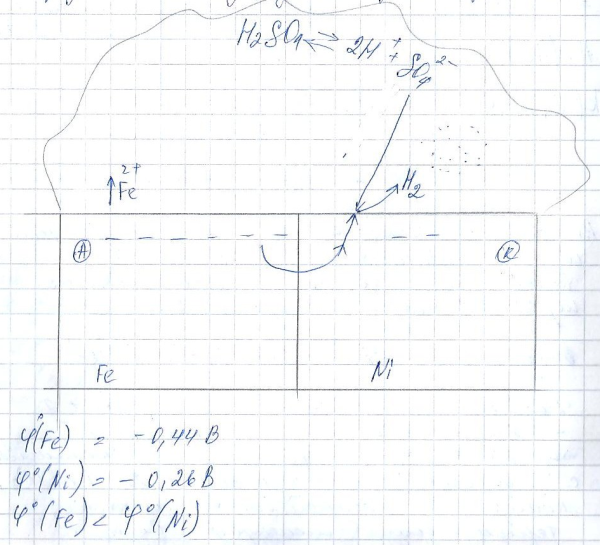 анодный процесс остаётся тем же самым, так как железо более активный металл, оно окисляется.
анодный процесс остаётся тем же самым, так как железо более активный металл, оно окисляется.
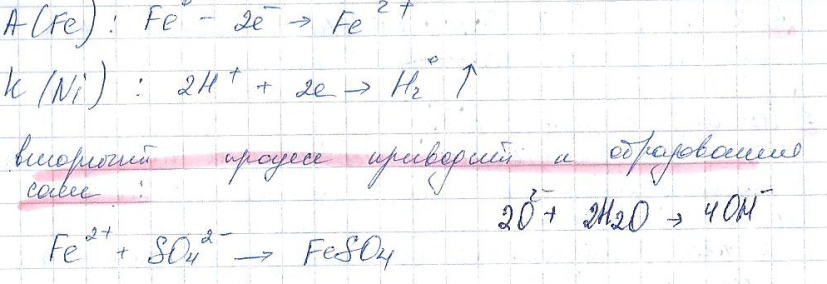
8. факторы влияющие на скорость коррозионных разрушений.
1. состав и св-ва агрессивной среды(в кислой среде быстрее, чем в нейтр. и щелоч.)
2.температура (при повышении быстрее из-за разрушения пленки)
3.состав сплава и его структура(у металлов с близкими значениями потенциалов коррозия <чем у тех, у кого большая разница)
4. состояние поверхности(для снижения коррозии её делаю гладкой)
5.степень аэрации(доступа кислорода)
Методы борьбы:
· Воздействие на металл
· Воздействие на окружающую среду
на металл:
· Легирование(внедрение в структуру металла другого более стойкого к коррозии)
· Защитные покрытия
· Электрохимическая

Смотри лаб раб
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 771; Нарушение авторских прав?; Мы поможем в написании вашей работы!