
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая термодинамика. Основные понятия. Первый закон
Билет №2
Катализ. Гомологический катализ.
Определение эквивалента сложных веществ.
Закон эквивалентов
Все вещества реагируют друг с другом в количествах, равных или пропорциональных их химическим эквивалентам.
Химическим эквивалентом называется такое весовое количесвто, которое без остатка взаимодействует с 1г. водорода или же вытесняет такое количество водорода из кислоты.
m1/m2=Э1/Э2
Для расчета эквивалента элемента надо его атомную массу разделить на его валентность.
1. Экислоты=Mrкислоты/основность
Для расчета эквивалента кислоты надо молярную массу разделить на основность.
4) Расчет эквивалентов оснований.
Эоснования=Mrоснования/кислотность(количество ОН)
5) Расчет эквивалентов солей и окидов.
Эсолей=Mrсоли/оксида/число атомов металла*валентность
Необходимо делить на произведение числа атомов металла и его валентность.
Основные положения теории Арениуса.
Чтобы произошло химическое взаимодействие, надо:
1) столкновение молекул
2) энергия молекул должна быть больше или равна энергии активации
3) столкновение должно приходится на функциональную группу.
Недостатки теории.
1) Реальная скорость часто оказывается ниже, чем рассчитанная по теореме Арениуса
2) Она не объясняет явление катализа.
Теория активированного состояния или переходного комплекса.
H2+J2=2HJ
В ходе химической реакции взаимодействия продукты образуются не сразу после столкновения исходных веществ, а сначала образуется промежуточный комплекс. Это реальная молекула, в которой старые связи ещё не совсем разорвались, а новые связи не совсем образованы.
При распаде активированного комплекса образуются продукты реакции. Т.о. энергия активации – это энергия, которая затрачивается на образование активного комплекса.
Катализатор только образует промежуточный комплекс и не меняется в ходе реакции химически (он снижает энергию активации реакции).
Ингибиторы – повышают энергию активации.
Термодинамика изучает законы, которые описывают обмен энергии между системой и окружающей средой и, в частности, превращение тепловой энергии в другие формы энергии.
Но не изучает протекание процессов во времени.
Классическая термодинамика изучает макроскопические свойства веществ, а статистическая – микроскопические свойства, от которых зависят макроскопические.
Классическая термодинамика базируется на трех законах, которые установлены опытным путем.
Основные понятия.
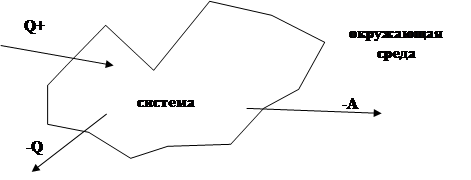
Всю Вселенную условно можно разбить на систему, которая подвергнута теоретическому и экспериментальному изучению и окружающую среду. Если система не обменивается с внешней средой ни веществом, ни энергией, то система называется изолированной. Если наоборот, то открытая. Если обмен веществом невозможен, то закрытая.
|
 Система знаков.
Система знаков.
 |
Теплота и работа – форма передачи энергии. (Теплота – в форме хаотичного движения частиц; работа – в форме упорядоченного движения частиц).
Параметры состояния – величины, позволяющие определить состояние системы.(P, V, T, состав).
Различают экстенсивные (m, V) и интенсивные параметры состояния.
Функции состояния.
Функция F параметров состояния (P, V, T) – называется функцией состояния, если её значение зависит только от параметров состояния и не зависит от пути перехода системы от одного состояния в другое.
Потенциальная энергия является функцией состояния, так как она не зависит от пути перехода из одного состояния в другое, а зависит только от разности высот.
DUпот.=mgDh
Рассмотрим процесс расширения идеального газа.
 | |||
| |||
1. Обратимый процесс – такое превращение, если система бесконечно медленно переходит из одного состояния равновесия в другое через промежуток равновесных состояний.
При этом параметр системы и окружающей среды отличается друг от друга на бесконечно малую величину.
Система находится в состоянии равновесия, если значение параметров одинаково во все точках и остается фиксированным, т.е. неизменным во времени.
При этом одновременно осуществляется термическое равновесие, механическое равновесия (давление) и химическое (состав).
P внутр= P внеш
A=v1òV2 P внешdT= - P внеш(V2-V1)
2. Необратимый процесс.
P внутр ¹ P внеш
PV=nRT
P=nRT/V
A= - v1òV2nRTdv/v= - nRTLnv2/v1
Т.о. величина A зависит от пути процесса (обратимого или необратимого), поэтому А не является функцией состояния и её бесконечно малые изменения обозначаются: dA.
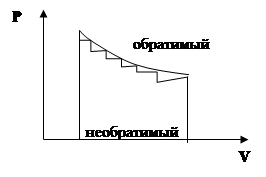
1 закон термодинамики. Подводящееся к системе тепло тратится на изменение внутренней энергии системы и на совершение работы.
DU=A+Q
|
| |||
 | |||
Частный случай:
1) Если система совершает циклическое превращение и возвращается в исходное состояние, то изменение внутренней энергии равно 0.
2) Процессы при V=const.
Рассмотрим только механическую работу расширения газа.
A=-pDV=0 Следовательно: DU=Qv
Физический смысл: то тепло, которое сообщается системе при V=const. (тепловая энергия при постоянном объеме).
3) Процессы при P=const
DU=U2-U1=A+Q
Qp=(U2+pV2)-(U1-pV1)=H2-H1=DH
H-энтальпия
Qp – изменение теплоты при постоянном давлении.
H=U+pV
|
|
Дата добавления: 2015-04-24; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!