
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости Условия образования и ратсворения осадков. Ионный обмен и ионообменники
Билет 24.
1. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
Электролиз - окислительно-восстановительный процесс протекающий на электродах при прохождении эл тока через расплав или раствор электролита.
Сущность электролиза состоит в том, что за счет эл энергии осуществляется реакция, которая не может протекать самопроизвольно.
ФАРАДЕЯ ЗАКОНЫ, основные законы электролиза, отражающие общий закон сохранения в-ва в условиях протекания злектрохим. р-ции. Установлены M. Фарадеем в 1833-34. Согласно 1-му закону, масса в-ва т, прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и времени электролиза t, т. е. кол-ву пропущенного электричества Q = It. Согласно 2-му закону, для разных электродных процессов при одинаковом кол-ве пропущенного электричества Q массы прореагировавших в-в относятся друг к другу так же, как молярные массы эквивалентов этих в-в. Оба Ф. з. объединяются одним ур-нием:
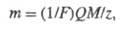
где Mz - мол. м. эквивалента в-ва, участвующего в электролизе. F - Фарадея постоянная, равная 96500 Кл/моль.
Насыщенный раствор образуется в том случае, когда растворяемое вещ-во больше уже не может растворяться в нем.Если растворяемое вещ-во представляет собой ионное соединение, то ионы в насыщенном растворе находятся в динамическом равновесии с избыточным, нерастворившимся тв вещ-вом. Например, в насыщенном растворе хлорида серебра устанавливается следующее равновесие: AgCl(тв)=Ag+(водн)+Cl-(водн)
Константа этого равновесия определяется выражением: Kпр=([Ag+][Cl-])равн
K-произведение растворимости хлорида серебра.Растворимость хлорида серебра можно выразить через концентрацию с растворенного AgCl в воде.Эта концентрация совпадает с конц обоих ионов в растворe [Ag]=[Cl]=c
Кпр=с 2
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре.Эта величина количественно характеризует способность электролита растворяться.
Условие образования и растворения осадков: произведение растворимостей могут использоваться для предсказания условий осаждения солей из раствора.Если произведение концентраций ионов в двух смешиваемых растворах превосходит произведение растворимости, то после смешивания раствора будет происходить осаждение осадка, до тех пор, пока произведение концентраций ионов не станет меньше произведения растворимости.
Ионный обмен-это процесс, в результате которого ионы, находящиеся в твердой фазе,обмениваются с ионами, находящимися в растворе.
Ионообменники: катионообменники, анионообменники.Когда твердый катионообменник приходит в соприкосновение с раствором, в котором содержатся какие-либо ионы, между ними устанавливается равновесие.
Ионный материал можно регенерировать(восстанавливать)
Анионообменник удаляет из раствора анионы.Для регенерации анионообменника может использоваться какое-либо основание.
|
|
Дата добавления: 2015-04-24; Просмотров: 370; Нарушение авторских прав?; Мы поможем в написании вашей работы!