
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атомов. Модель атома по Резенфорду, по Бору
Основные химические законы и понятия.
Ответ: Материя – это весь окружающий нас мир, который проявляется в формах вещества и поля. Поле – это форма существующей материи, которая характеризуется энергией, посредством поля осуществляющая взаимодействие между частицами вещества. Неотъемлемым свойством материи является – движение. Мерой движения материи служит – энергия. Мерой энергии материи является – масса. Энергия и масса важнейшие взаимосвязанные свойства материи. Закон сохранения массы энергии: Уравнение Энштейна: E=mc2, где c – скорость света в вакууме (c=3*108 м/с). В изолированной системе сумма масс и энергий постоянна (1905 г.). Тепловой эффект большинства веществ: от 10 до 1000 кДж/моль. Закон постоянства составов: Всякое чистое вещество не зависимо от способа его получения имеет постоянный качественный и количественный состав (Ж. Пруста, К. Бертолле 1801-1808 г). 1912-1913г – Н.С. Курнаков – установил что существует огромное количество составов. Дальтониды – вещества постоянного состава (молекулярной структуры). Бертоллиды – вещества переменного состава (кристаллическая структура). Как вытекает из закона постоянства составов - было показано в работах И. Рихтера (1792г. – 1800г.) Элементы взаимодействуют между собой в строго определённых количественных соотношениях то есть можно говорить об эквивалентности при образовании химических соединений (закон Эквивалента).
Ответ: Атомы всех элементов – состоят из: положительно заряженного ядра, и электронной оболочки. Ядро – занимает ничтожную часть атома. Атом водорода (H): диаметр атома примерно 10-8 см. (1 Аo (ангстрем); 0,1 нм), диаметр ядра 10-13 см. Однако практически вся масса атома – сосредоточена в ядре т.е. ядра обладают – чрезвычайно высокой плотностью. 1 см3 ядер – весит 116.000.000 тонн. Электрон  - это микрочастица обладающая элементарным отрицательным зарядом – т.е. таким количеством электричества – меньше которого в природе не существует. Заряд
- это микрочастица обладающая элементарным отрицательным зарядом – т.е. таким количеством электричества – меньше которого в природе не существует. Заряд  =1,6*10-19 Кл; масса
=1,6*10-19 Кл; масса  =9,11*10-28 г. В химических реакциях – ядра атомов – остаются без изменений, а меняются лишь их – электронные оболочки.
=9,11*10-28 г. В химических реакциях – ядра атомов – остаются без изменений, а меняются лишь их – электронные оболочки.
По модели Резенфорда – в центре атома находятся положительно заряженное ядро, а вокруг него (ядра) – движутся электроны, число которых – равно заряду ядра.  Fц – центробежная сила,
Fц – центробежная сила,  Fк – сила Кулоновского притяжения,
Fк – сила Кулоновского притяжения, 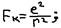 Условие устойчивого движения электронов – вокруг ядра: Fк=Fц, или
Условие устойчивого движения электронов – вокруг ядра: Fк=Fц, или  , где m – масса электрона;
, где m – масса электрона;  - его скорость; r – радиус орбиты, e – заряд: электрона и ядра. Здесь:
- его скорость; r – радиус орбиты, e – заряд: электрона и ядра. Здесь:  и r – в формуле неизвестны – это недостаток формулы. Недостатки модели Резенфорда: 1)не могла объяснить – устойчивость атома. Движущийся электрон, изучая энергию – замедляет скорость вращения, и должен упасть на ядро (т.к. r – тоже уменьшается), но этого не происходит; 2)не могла объяснить – наличие линейчатых спектров в раскалённых: газах, и парах, в то время как: раскалённые, жидкие, и твёрдые тела – дают сплошной спектр.
и r – в формуле неизвестны – это недостаток формулы. Недостатки модели Резенфорда: 1)не могла объяснить – устойчивость атома. Движущийся электрон, изучая энергию – замедляет скорость вращения, и должен упасть на ядро (т.к. r – тоже уменьшается), но этого не происходит; 2)не могла объяснить – наличие линейчатых спектров в раскалённых: газах, и парах, в то время как: раскалённые, жидкие, и твёрдые тела – дают сплошной спектр.
Немецкий физик М. Планк (1901г.) – установил что – лучистая энергия: испускается, и поглощается телами не непрерывно, а дискретно т.е. отдельными порциями – квантами, это положение справедливо и для атомов. Энергия кванта:  , где h – постоянная Планка (h=6,63*10-34 Дж*с),
, где h – постоянная Планка (h=6,63*10-34 Дж*с),  - частота, Гц (1 Гц=1
- частота, Гц (1 Гц=1  ). Постулаты Бора: 1 постулат: Электроны в атоме – могут вращаться лишь по строго определённым орбитам, дозволенным – квантовой теорией, такие орбиты называются – стационарными. а)радиусы стационарных орбит – относятся друг к другу – как квадраты целых чисел натурального ряда: r1:r2:r3…=12:22:32…
). Постулаты Бора: 1 постулат: Электроны в атоме – могут вращаться лишь по строго определённым орбитам, дозволенным – квантовой теорией, такие орбиты называются – стационарными. а)радиусы стационарных орбит – относятся друг к другу – как квадраты целых чисел натурального ряда: r1:r2:r3…=12:22:32…  б)скорость электрона на стационарных орбитах – выражается соотношением:
б)скорость электрона на стационарных орбитах – выражается соотношением: 
 n=1: r1=0,53 Аo,
n=1: r1=0,53 Аo,  =2200 км/с, n=2: r2=2,12 Аo,
=2200 км/с, n=2: r2=2,12 Аo,  =1100 км/с. С удалением электрона от ядра – его кинетическая энергия (Eк) убывает т.к. его скорость уменьшается, но зато растёт – потенциальная энергия (Eп) (в 2 раза быстрее – чем Eк), т.е. общая энергия (E=Ek+Eп) электрона с удалением от ядра – возрастает. 2 постулат: Вращаясь по стационарной орбите – электрон не излучает электромагнитную энергию. 3 постулат: Излучение энергии – происходит при “скачкообразном” переходе электрона с одной стационарной орбиты – на другую, при этом: излучается, или поглощается квант энергии – равный разности энергии электрона на: дальних, и на ближних орбитах. Существуют: “нормальное” и “возбуждённое” состояние атома. В “нормальном” состоянии – электрон находится на ближайшей к ядру орбите, и обладает наименьшей энергией – это самое устойчивое состояние. Поглотив квант энергии – электрон преодолевает электростатическое приближение к ядру, и перескакивает на более удалённую орбиту (это: “возбуждённое”, неустойчивое состояние) длится – миллиардную долисекунду, после чего – электрон вновь возвращается в прежнее состояние – испуская ранее поглощённый квант энергии. Эти перескоки электрона, и являются причиной – линейчатых спектров. Недостатки модели Бора: 1)не могла объяснить расщепление спектральных линий – у многоэлектронных атомов; 2)не ясно было, где находится электрон – в момент его перехода с одной стационарной орбиты – на другую.
=1100 км/с. С удалением электрона от ядра – его кинетическая энергия (Eк) убывает т.к. его скорость уменьшается, но зато растёт – потенциальная энергия (Eп) (в 2 раза быстрее – чем Eк), т.е. общая энергия (E=Ek+Eп) электрона с удалением от ядра – возрастает. 2 постулат: Вращаясь по стационарной орбите – электрон не излучает электромагнитную энергию. 3 постулат: Излучение энергии – происходит при “скачкообразном” переходе электрона с одной стационарной орбиты – на другую, при этом: излучается, или поглощается квант энергии – равный разности энергии электрона на: дальних, и на ближних орбитах. Существуют: “нормальное” и “возбуждённое” состояние атома. В “нормальном” состоянии – электрон находится на ближайшей к ядру орбите, и обладает наименьшей энергией – это самое устойчивое состояние. Поглотив квант энергии – электрон преодолевает электростатическое приближение к ядру, и перескакивает на более удалённую орбиту (это: “возбуждённое”, неустойчивое состояние) длится – миллиардную долисекунду, после чего – электрон вновь возвращается в прежнее состояние – испуская ранее поглощённый квант энергии. Эти перескоки электрона, и являются причиной – линейчатых спектров. Недостатки модели Бора: 1)не могла объяснить расщепление спектральных линий – у многоэлектронных атомов; 2)не ясно было, где находится электрон – в момент его перехода с одной стационарной орбиты – на другую.
3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
Ответ: Луи де Бройль в 1924г. сказал: частицы которые ранее считались корпускулярными – обладают также, и волновыми свойствами. Длина волны:  ,
,  - импульс,
- импульс,  У тела с большой массой – волновой характер не ощутим т.к.
У тела с большой массой – волновой характер не ощутим т.к.  - очень мала. А)ПУМ
- очень мала. А)ПУМ  =3,0*10-25 Аo. б)электрон
=3,0*10-25 Аo. б)электрон  =2,4 Аo. Электрон в вакууме – имеет двойственную природу: на ряду с корпускулярными свойствами – он обладает и волновыми свойствами, потому его называют: не частицей и не волной, а квантовым объектом, или микрочастицей.
=2,4 Аo. Электрон в вакууме – имеет двойственную природу: на ряду с корпускулярными свойствами – он обладает и волновыми свойствами, потому его называют: не частицей и не волной, а квантовым объектом, или микрочастицей.
Нельзя одновременно точно определить: и координату, и импульс электрона. Можно определить лишь – относительную вероятность нахождения электрона: в том, или ином месте атома: 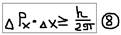 , где:
, где:  - неопределённость (ошибка в определении) величины импульса;
- неопределённость (ошибка в определении) величины импульса; 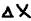 - неопределённость (ошибка в определении) в величине координат (в месте нахождения электронов).
- неопределённость (ошибка в определении) в величине координат (в месте нахождения электронов).
|
|
Дата добавления: 2015-04-24; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!