
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость гетерогенных реакций. Гетерогенный катализ
|
|
|
|
Ответ: Скорость химической реакции  - измеряется изменением концентрации реагирующих химических веществ в единицу времени
- измеряется изменением концентрации реагирующих химических веществ в единицу времени  . [c]=[моль/л], [
. [c]=[моль/л], [  ]=[мин,с],
]=[мин,с],  =[моль/л*мин или моль/л*с]. Рассмотрим некоторую реакцию: А+B=AB. Уменьшим концентрацию всех А и В и увеличим концентрацию АВ может протекать по линейному механизму
=[моль/л*мин или моль/л*с]. Рассмотрим некоторую реакцию: А+B=AB. Уменьшим концентрацию всех А и В и увеличим концентрацию АВ может протекать по линейному механизму  и по более сложному не линейному
и по более сложному не линейному  .
.  Скорость в пределах
Скорость в пределах  - скорость постоянна, её называют – средней скоростью. Vср – определяется
- скорость постоянна, её называют – средней скоростью. Vср – определяется  угла наклона прямой
угла наклона прямой  к оси времени.
к оси времени.  В этом случае скорость реакции в пределах
В этом случае скорость реакции в пределах  не постоянна, а изменяется, чем меньше
не постоянна, а изменяется, чем меньше  , тем ближе
, тем ближе  сред. приближается к истинной в момент времени
сред. приближается к истинной в момент времени  . Когда
. Когда  стремится к 0 получаем истинную (мгновенную) скорость:
стремится к 0 получаем истинную (мгновенную) скорость:  .
.  определяется
определяется  угла наклона к касательной кривой
угла наклона к касательной кривой  к оси времени. Факторы влияющие на скорость реакции: 1)природа реагирования вещества; 2)концентрация; 3)температура; 4)давление (для реакций с участием газов и паров); 5)присутствие катализатора и др. Мы знаем, что элемент активного взаимодействия происходит при столкновении молекул, однако не каждое столкновение приводит к реакции. Результат бывают столкновения только между активными молекулами. Активные молекулы – это молекулы обладающие повышенным запасом энергии, достаточным для осуществления данной реакции. Активные молекулы – появляются в результате перераспределении энергии которая происходит при их столкновении друг с другом не приводящие к реакции.
к оси времени. Факторы влияющие на скорость реакции: 1)природа реагирования вещества; 2)концентрация; 3)температура; 4)давление (для реакций с участием газов и паров); 5)присутствие катализатора и др. Мы знаем, что элемент активного взаимодействия происходит при столкновении молекул, однако не каждое столкновение приводит к реакции. Результат бывают столкновения только между активными молекулами. Активные молекулы – это молекулы обладающие повышенным запасом энергии, достаточным для осуществления данной реакции. Активные молекулы – появляются в результате перераспределении энергии которая происходит при их столкновении друг с другом не приводящие к реакции. 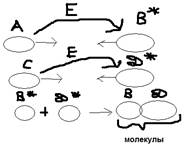 Число активных молекул определяется по формуле: Масквелла-Больцмана:
Число активных молекул определяется по формуле: Масквелла-Больцмана:  , где: n – число активным молекул, n0 – общее число молекул, e – основание натурального логарифма, R – универсальная газовая постоянная, Т – температура по Кельвину, Eакт (кДж/моль) – энергия активации. Энергии активации – это энергия необходимая для преодоления силы отталкивания электронных оболочек с ударяющейся молекулой, более строгая объяснение на примере конкретной реакции:
, где: n – число активным молекул, n0 – общее число молекул, e – основание натурального логарифма, R – универсальная газовая постоянная, Т – температура по Кельвину, Eакт (кДж/моль) – энергия активации. Энергии активации – это энергия необходимая для преодоления силы отталкивания электронных оболочек с ударяющейся молекулой, более строгая объяснение на примере конкретной реакции:  Преобразуя активные комплекса одновременно разрывает старые связи (затраты E) и образуются новые связи выделение E, в результате общей её активной равной их сумме меньшей. Энергия которая необходима для перевода реагирующих веществ в состояние активного комплекса и есть энергия активнее, чем Eа меньше чем выше реакций способной молекулы. Условно: Eакт<40 кДж/моль – быстрые реакции; Eакт.=40-120 – реакция средней скорости, Eакт>120 – медленные реакции. Другим важным фактором – является взаимная ориентация активной молекулы в момент соударения. Чтобы прошла реакция активной молекулы должны столкнуться активными участками. Вероятность надлежащей ориентации активных молекул в момент соударения определяется энтропией активации (Sакт):
Преобразуя активные комплекса одновременно разрывает старые связи (затраты E) и образуются новые связи выделение E, в результате общей её активной равной их сумме меньшей. Энергия которая необходима для перевода реагирующих веществ в состояние активного комплекса и есть энергия активнее, чем Eа меньше чем выше реакций способной молекулы. Условно: Eакт<40 кДж/моль – быстрые реакции; Eакт.=40-120 – реакция средней скорости, Eакт>120 – медленные реакции. Другим важным фактором – является взаимная ориентация активной молекулы в момент соударения. Чтобы прошла реакция активной молекулы должны столкнуться активными участками. Вероятность надлежащей ориентации активных молекул в момент соударения определяется энтропией активации (Sакт):  ,
, 
|
|
|
Гетерогенный катализ: При таком катализе реакции протекает на поверхности катализатора. Отсюда следует, что активный катализатор зависит от величины и свойств его поверхности. Для того, чтобы иметь большую “развитую” поверхность, катализатор должен обладать либо пористой поверхностью, либо находиться в мелко раздробленном состоянии. Схема гетерогенного катализа: 1)адсорбция (поглощение катализатором исходного вещества); 2)химическая реакция (на поверхности катализатора); 3)десорбция (удаление с поверхности катализатора продуктов реакции). Пример: 
22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
Ответ: Растворимость – это способность одного вещества растворяться в другом, количественно растворимость определяется концентрацией насыщенности раствора. По растворимости все вещества делятся на 3 группы: а)легко растворимые >1 в 100 г. H2O; б)труднорастворимые 1-0,001г в 100 г. H2O; в)практически нерастворимые <0,001г в 100 г. H2O. Абсолютно нерастворимых веществ в природе не существует. Растворимость газа в жидкости: Увеличивается с повышением раствора и понижением температуры T (к). Зависимость температуры от давления определяется в Генри. C=K*P. При постоянной температуре растворимость t газа в жидкости прямо пропорционально растворимости газа в жидкости. Где: С – растворимость (г/л); P – давление, K – коэффициент Генри. Растворимость жидкости в жидкостях: Жидкость в жидкости может растворяться: а)не ограничено (спирт+вода); б)ограничено (вода+вино); в)совсем не растворяет (вода+бензол). Растворимость твёрдых тел в жидкостях: Как правило увеличивается с повышением температуры (t), (но бывают исключения) и практически не зависит от p (давления). Для удобства растворимость твёрдых тел изображают в виде кривых растворимости: 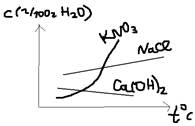
|
|
|
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 708; Нарушение авторских прав?; Мы поможем в написании вашей работы!