
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория гальванических элементов
Ответ: Гальванический элемент – это система, которая химически энергию окисляет-восстанавливает процессом превращения в электрическую энергию. Раньше мы установили, что при погружении металла в раствор, его соли вызвали равновесие:  Равновесие (1) может быть нарушено двояко, если мы будем удалять электричество с металлической пластинки, то равновесие смещается вправо, что вызовет раствор пластины.
Равновесие (1) может быть нарушено двояко, если мы будем удалять электричество с металлической пластинки, то равновесие смещается вправо, что вызовет раствор пластины.  Если наобород подведём электрический ток к пластине из вне, то равновесие сместиться влево, что вызовет восстановление ионов металла из раствора. Оба эти процесса не происходят. Медно-цинковый элемент Даниеля-Якоби: При погружении пластины из Cu и Zn в раствор их солей возникает равновесие (аналогичное 1). Способное растворить у цинка больше, чем у Cu (от н активнее). Поэтому и концентрация электронов на цинке будет больше чем на меди. Если теперь соединить эти пластины вместе проводником, то электроны будут перемещаться, это вызовет нарушение равновесия 2 и 3.
Если наобород подведём электрический ток к пластине из вне, то равновесие сместиться влево, что вызовет восстановление ионов металла из раствора. Оба эти процесса не происходят. Медно-цинковый элемент Даниеля-Якоби: При погружении пластины из Cu и Zn в раствор их солей возникает равновесие (аналогичное 1). Способное растворить у цинка больше, чем у Cu (от н активнее). Поэтому и концентрация электронов на цинке будет больше чем на меди. Если теперь соединить эти пластины вместе проводником, то электроны будут перемещаться, это вызовет нарушение равновесия 2 и 3.  Отличие химического процесса от электро-химического процесса: При химическом процессе электроны от цинка к меди переходят непосредственно, а в электролит – химически через внешний проводник.ю Однако процесс быстро прекращается.
Отличие химического процесса от электро-химического процесса: При химическом процессе электроны от цинка к меди переходят непосредственно, а в электролит – химически через внешний проводник.ю Однако процесс быстро прекращается.  а)в левом сосуде – будут накапливаться катионы Zn2+ и препятствовать дальнейшему растворению цинка. б)в правом сосуде – накапливаются анионы SO42- и они препятствуют восстановлению катионов Cu2+. Во избежание этого сосуды соединяют трубкой – заполненной электролитом или пористой перегородкой, что даёт возможность диффузии избыточных ионов Zn2+ и SO42- из одного сосуда в другой, теперь проще будет протекать самопроизвольно до полного растворения цинка или до полного восстановления Cu2+ из раствора. Различают: внутреннюю и внешнюю цепь гальванического элемента. Внутренняя цепь – это участие электрода погруженного в раствор своих солей и солей раствора являющихся проводником второго рода. Всё остальное – внешнее. Мы рассматривает только внутреннюю цепь. Для внутренней цепи: (-) Анод (-А) – это электрод на котором протекает процесс окисления, он отдаёт электроны во внешнюю цепь, это более активный металл. Для внешней цепи он (-K). (+K) – это электрод на котором протекает процесс восстановления, он принимает электроны из внешней цепи, это менее активные металлы, для внешней цепи он (А+). Схематическое изображение Г.Э. (гальванического элемента):
а)в левом сосуде – будут накапливаться катионы Zn2+ и препятствовать дальнейшему растворению цинка. б)в правом сосуде – накапливаются анионы SO42- и они препятствуют восстановлению катионов Cu2+. Во избежание этого сосуды соединяют трубкой – заполненной электролитом или пористой перегородкой, что даёт возможность диффузии избыточных ионов Zn2+ и SO42- из одного сосуда в другой, теперь проще будет протекать самопроизвольно до полного растворения цинка или до полного восстановления Cu2+ из раствора. Различают: внутреннюю и внешнюю цепь гальванического элемента. Внутренняя цепь – это участие электрода погруженного в раствор своих солей и солей раствора являющихся проводником второго рода. Всё остальное – внешнее. Мы рассматривает только внутреннюю цепь. Для внутренней цепи: (-) Анод (-А) – это электрод на котором протекает процесс окисления, он отдаёт электроны во внешнюю цепь, это более активный металл. Для внешней цепи он (-K). (+K) – это электрод на котором протекает процесс восстановления, он принимает электроны из внешней цепи, это менее активные металлы, для внешней цепи он (А+). Схематическое изображение Г.Э. (гальванического элемента): 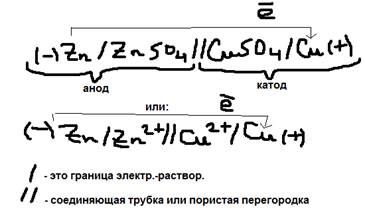 Вычисление ЭДС гальванического элемента: ЭДС – это разность потенциалов гальванического элемента, если сила тока в нём равна 0, величина всегда положительная, её определяют вычислением из потенциала катода – потенциал анода. Если металл погрузить в раствор своих солей концентрация которых отличается от одномолярной, то в начале с помощью уравнения Нернста определяют электрический потенциал обоих металлов, выясняют какой из них катод, а какой анод, а затем из потенциала катода вычисляют потенциал анода. ЭДС=Eк-Eа. Пример: Определить ЭДС гальванического элемента в котором:
Вычисление ЭДС гальванического элемента: ЭДС – это разность потенциалов гальванического элемента, если сила тока в нём равна 0, величина всегда положительная, её определяют вычислением из потенциала катода – потенциал анода. Если металл погрузить в раствор своих солей концентрация которых отличается от одномолярной, то в начале с помощью уравнения Нернста определяют электрический потенциал обоих металлов, выясняют какой из них катод, а какой анод, а затем из потенциала катода вычисляют потенциал анода. ЭДС=Eк-Eа. Пример: Определить ЭДС гальванического элемента в котором: 
|
|
Дата добавления: 2015-04-24; Просмотров: 3406; Нарушение авторских прав?; Мы поможем в написании вашей работы!