
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея
|
|
|
|
Ответ: Электролиз: Окислительно-восстановительные реакции протекающие на электродах при пропускании постоянного электрического тока через раствор или расплав электролита называется – электролизом. Отличие от гальванического элемента: а)в гальваническом элементе анод (-) т.е. (-)А; а в электролизе: +(А), катод (+), т.е. в электролизе (-К). Хотя полюсность меняется, но процессы протекают одни и те же. На: (+) Анод – окислитель; (-) Катод – восстановитель. 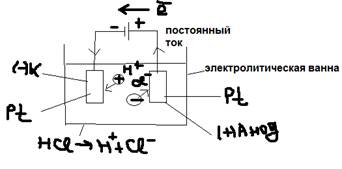 - включим источник постоянного тока, его можно рассмотреть на “насосе” который “выкачивает” электролит с (+) Анода и “перекачивает” их на (-) катод. В результате это вызовет недостаток электролита но (+) анода и их избыток, но (-) катода. Что вызовет направленное движение ионов в электролите:
- включим источник постоянного тока, его можно рассмотреть на “насосе” который “выкачивает” электролит с (+) Анода и “перекачивает” их на (-) катод. В результате это вызовет недостаток электролита но (+) анода и их избыток, но (-) катода. Что вызовет направленное движение ионов в электролите: 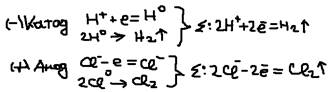
Процессы протекающие на аноде и катоде: (-) катод: а)восстановление катиона элект. до нейтральных атомов и молекул: 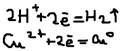 б)восстановление молекул воды:
б)восстановление молекул воды: 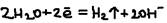 (+) Анод (окисляется): а)окисление (раствор.) анода: CuO-2e=Cu2+ (Ni, Fe, Zn…). Такой анод называется – растворимым. Если же анод является только провод. электр., а сам свою элект. не отд. источник тока, она называется нерастворимым (Pt, Au, графит). Б)окисление анионов электролита: 2Cl+2e=Cl2; 4OH-4e=O2+2H2O. в)окисление молекулы воды: 2H2O-4e=O2+4H+.
(+) Анод (окисляется): а)окисление (раствор.) анода: CuO-2e=Cu2+ (Ni, Fe, Zn…). Такой анод называется – растворимым. Если же анод является только провод. электр., а сам свою элект. не отд. источник тока, она называется нерастворимым (Pt, Au, графит). Б)окисление анионов электролита: 2Cl+2e=Cl2; 4OH-4e=O2+2H2O. в)окисление молекулы воды: 2H2O-4e=O2+4H+.
Закон Фарадея: 1 закон: Масса вещества выделенная, на электролите при электролизе прямо пропорциональна количеству электричества прошедшего через электролит и не зависит от других факторов. m=Кэ*Q. Q=I*t [A*c]. 1А*с=1 Кл. m=Кэ*I*t, где: Кэ – это количество электрохимического эквивалента, он равен массе вещества выделяющегося при прохождения 1 Кл электричества. 2 Закон: Одинаковое количества электричества выделенного на электролите при электролизе эквивалента массе различных веществ. 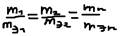 то есть для выделенного одной эквивалентной массе любого вещества требуется одно и тоже количества электричества. 96500 Кл (число Фарадея, F). (F=N*e=6,02*1023*1,6*10-19=96500 Кл).
то есть для выделенного одной эквивалентной массе любого вещества требуется одно и тоже количества электричества. 96500 Кл (число Фарадея, F). (F=N*e=6,02*1023*1,6*10-19=96500 Кл). 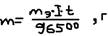 ,: где: m – масса выделенного вещества на электролите [г], mэ – эквивалентная масса выделенного вещества [г/моль], I – сила тока [А], t – время [с]. Для газов:
,: где: m – масса выделенного вещества на электролите [г], mэ – эквивалентная масса выделенного вещества [г/моль], I – сила тока [А], t – время [с]. Для газов: 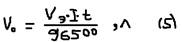 , где: V0 – объём выделенного газа (в нормальных условиях), Vэ – эквивалентный объём газа, Vэ/H2, Cl2=11,2 л; O2=5,6 л. Задача: Сколько меди выделится при электролизе: CuSO4, I=4А, t=1 час. Решение: из (5)
, где: V0 – объём выделенного газа (в нормальных условиях), Vэ – эквивалентный объём газа, Vэ/H2, Cl2=11,2 л; O2=5,6 л. Задача: Сколько меди выделится при электролизе: CuSO4, I=4А, t=1 час. Решение: из (5) 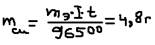 Показателем эффективности электричества является выход потока (КПД):
Показателем эффективности электричества является выход потока (КПД):  , где:
, где: 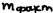 - фактически выделенная масса,
- фактически выделенная масса, 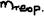 - теоретически возможное.
- теоретически возможное.
|
|
|
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1187; Нарушение авторских прав?; Мы поможем в написании вашей работы!