
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Высшие кислородосодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств
Фосфор образует целый ряд кислородсодержащих кислот (оксокислот). Некоторые из них мономерны. например фосфиновая, фосфористая и фосфорная(V) (ортофосфорная) кислоты. Кислоты фосфора могут быть одноосновными (однопротонными) либо многоосновными (многопротонными). Кроме того, фосфор образует еще полимерные оксокислоты. Такие кислоты могут иметь ациклическое либо циклическое строение. Например, дифосфорная(V) (пирофосфорная) кислота представляет собой димерную оксокислоту фосфора.
Наиболее важной из всех этих кислот является фосфорная(V) кислота (другое ее название - ортофосфорная кислота). При нормальных условиях она представляет собой белое кристаллическое вещество, расплывающееся при поглощении влаги из воздуха. Ее 85%-ный водный раствор называют «сиропообразной фосфорной кислотой». Фосфорнця(V) кислота является слабой трехосновной кислотой:

Хлор образует несколько кислородсодержащих кислот. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и сила кислоты:
НОCl < НСlO2 < НСlO3 < НClO4
НClO3 и НClO4 – сильные кислоты, причем НСlO4 – одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только НСlO4 удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием его степени окисления:

НОСl и НClO2 – особенно хорошие окислители. Например, кислый раствор НОCl:
1) окисляет ионы железа (II) до ионов железа (III):
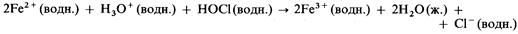
2) на солнечном свету разлагается с образованием кислорода:

3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат (V)-ионы:

Остальные высшие кислотсодержащие кислоты элементов третьего периода (H3AlO3, H2SiO3) более слабые, чем фосфорная кислота. Серная кислота (H2SO4) менее сильнае, чем хлорная (VII) кислота, но более сильная, чем фосфорная кислота. Вообще, при увеличении степени окисления элемента, образующего кислоту, увеличивается сила самой кислоты:
H3AlO3 < H2SiO3 < H3PO4 < H2SO4 < НСlO4
|
|
Дата добавления: 2015-04-24; Просмотров: 2310; Нарушение авторских прав?; Мы поможем в написании вашей работы!