
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды азота 5 страница
|
|
|
|
В разбавленных соляной и серной кислотах железо растворяется, т. е. окисляется ионами водорода:

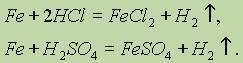
Растворяется железо и в разбавленной азотной кислоте, образуя соль железа (III), воду и продукт восстановления азотной кислоты NH3 или N2O и N2.
Концентрированные кислоты — окислители (HNO3, H2SO4) пассивируют железо на холоде, однако растворяют его при нагревании:
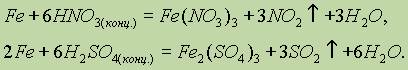
При высокой температуре (700-900° С) железо реагирует с парaми воды:
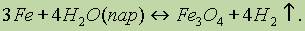
Накаленная железная проволока ярко горит в кислороде, образуя окалину — оксид железа (II, III):
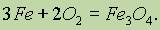
При слабом нагревании железо взаимодействует с хлором и серой, а при высокой температуре — с углем, кремнием и фосфором.
С металлами и неметаллами железо образует сплавы, имеющие исключительно большое значение в народном хозяйстве.
Для железа наиболее характерны два ряда соединений: соединения железа (II) и железа (III).
Оксид железа (II). Оксид железа (II) FeO — черный легко окисляющийся порошок. Получается восстановлением оксида железа (III) оксидом углерода (II) при 500° С:

FeO проявляет свойства основного оксида: легко растворяется в кислотах, образуя соли железа (II).
Оксид железа (III). Оксид железа (III) Fe2O3 — самое устойчивое природное кислородсодержащее соединение железа. Растворяясь в кислотах, образует соли железа (III).
Оксид железа (II-III). Оксид железа (II, III) Fe3O4 встречается в природе в виде минерала магнетита. Он хороший проводник тока, поэтому используется для изготовления электродов.
Оксидам соответствуют гидроксиды железа.
Гидроксид железа (II). Гидроксид железа (II) Fe(OH)2 образуется при действии щелочей на соли железа (II) без доступа воздуха:

Выпадает осадок белого цвета. В присутствии воздуха окраска делается зеленоватой, а затем бурой. Катионы железа (II) Fe2+ очень легко окисляются кислородом воздуха или другими окислителями в катионы железа (III) Fe3+. Поэтому в растворах соединений железа (II) всегда имеются катионы железа (III). По этой же причине белый гидроксид железа (II) Fe(OH)2 на воздухе становится сначала зеленоватым, а затем бурым, переходя в гидроксид железа (III) Fе(ОН)3:
|
|
|

Fe(OH)2 проявляет основные свойства, хорошо растворяется в минеральных кислотах, образуя соли.
Гидроксид железа (III). Гидроксид железа (III) Fe(ОН)3 образуется в виде красно-бурого осадка при действии щелочами на соли железа (III):
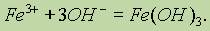
Fе(ОН)3 — более слабое основание, чем гидроксид железа (II). Это объясняется тем, что у Fе2+ меньше заряд иона и больше его радиус, чем у Fe3+ а значит, Fe2+ слабее удерживает гидроксид-ионы, т. е. Fе(ОН)2 более легко диссоциирует. Поэтому соли железа (II) гидролизуются незначительно, а соли железа (III) — очень сильно:
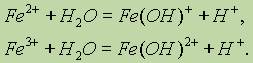
Гидроксид железа (III) обладает слабо выраженной амфотерностью: он растворяется в разбавленных кислотах и в концентрированных растворах щелочей:

Соли железа (II) и (III). Из солей железа наибольшее применение нашли: 1) гептагидрат сульфата железа (II) (железный купорос) FeSO4× 7Н2O для борьбы с вредителями растений, приготовления минеральных красок и т. д., 2) хлорид железа (III) FеСl3 как коагулянт при очистке воды, а также как протрава при крашении тканей; 3) нонагидрат сульфата железа (III) Fe2(SO4)3× 9Н2O как коагулянт, а также для травления металлов; 4) нонагидрат нитрата железа (III) Fе(NО3)3× 9Н2O как протрава при крашении хлопчатобумажных тканей и утяжелитель шелка.
Качественный реакции на ионы железа (II) и (III). Комплексные соединения железа. Катион железа (III) легко обнаруживается с помощью бесцветного раствора тиоцианата аммония NH4NCS или тиоцианата калия KNCS, точнее, тиоцианат-иона NCS-. При действии NCS- на раствор соли железа (III) образуется соединение кроваво-красного цвета — тиоцианат железа (III) Fе(NCS)3
|
|
|
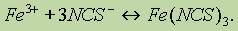
Тиоцианат-ион NCS" служит реагентом на катион железа (III) Fe3*.
Для обнаружения катиона железа (III) Fe3+ удобно применять сложное (комплексное) соединение железа гексацианоферрат (II) калия, т. наз. желтая кровяная соль, K4[Fe(CN)6]. В растворе эта соль диссоциирует на ионы:

При взаимодействии гексацианоферрат (II)-ионов [Fe(CN)6]4- с катионами железа (III) Fe3+ образуется темно-синий осадок — гексацианоферрат (II) железа (III) (берлинская лазурь):
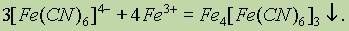
Другое сложное соединение железа гексацианоферрат (III) калия (красная кровяная соль) в растворе диссоциирует:

а при взаимодействии гексацианоферрат (III)-ионов [Fe(CN)6]3- с катионами железа (II) Fe2+ также образуется темно-синий осадок гексацианоферрат (III) железа (II) (турнбулева синь):
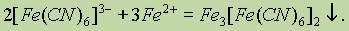
Таким Образом, соединения K4[Fe(CN)6] и K3[Fe(CN)6] являются важными реагентами соответственно на катион железа (III) Fe3+ и катион железа (II) Fe2+.
Ферраты железа (VI). Известно довольно небольшое число соединений железа (VI) — ферраты, например феррат калия K2FeO4, феррат бария BaFeO4 и феррат кальция СaFeO4.
Феррат калия образуется в результате реакции:
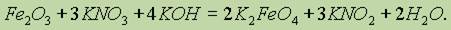
Предположения о существовании таких соединений как H2FeO4 и, соответственно, FeO3 не получили экспериментального подтверждения.
Ферраты термически нестабильные соединения и разлагаются уже при 200 ° С:
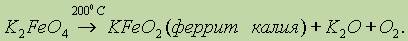
Феррат калия проявляет более сильную окислительную способность, чем перманганат:

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 647; Нарушение авторских прав?; Мы поможем в написании вашей работы!