
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение предельных одноатомных спиртов
|
|
|
|
В промышленности
1. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250°C и давлении 5-10 МПа:
СО + 2Н2 → СН3ОН
2. Этанол получают:
a) гидратацией этилена (Н3РО4; 280°C; 8 МПа)
СН2=СН2 + Н2О → СН3–СН2–ОН
b) брожением крахмала (или целлюлозы):
крахмал → С6Н12О6(глюкоза) ––ферменты→ 2С2Н5ОН + 2СО2
(источник крахмала – зерно, картофель)
В лаборатории
1. Гидратация алкенов (согласно правилу Марковникова):
СH3–СH=CH2 + H2O → СH3–CH– СH3
I
OH
2. Гидролиз галогенопроизводных углеводородов:
СH3–СH2–Br + H2O → СH3–CH2–OH + HBr
Чтобы сдвинуть равновесие вправо, добавляют щёлочь, которая связывает образующийся HBr.
Генетическая связь между углеводородами и спиртами
Произвести непосредственное окисление углеводорода в спирт довольно трудно. Практически проще это сделать через галогено-производное углеводорода. Например, чтобы получить этиловый спирт, исходя из этана, можно сначала получить бромистый этил по реакции: 
а затем бромистый этил превратить в спирт нагреванием с водой в присутствии щёлочи:

Щёлочь при этом нужна, чтобы нейтрализовать образующийся бромистый водород и устранить возможность реакции его со спиртом, т. е. сдвинуть эту обратимую реакцию вправо.
Подобным же образом метиловый спирт может быть получен по схеме:

48) Спирт этиловый (C2H5OH) - бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом.
Этиловый спирт смешивается во всех соотношениях с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином и др.Этиловый спирт горит бледно-голубым пламенем.
Химические свойства.
1. Р. Горения.
С2Н5ОН + 3О2 —> 2СО2 + 3Н2О + Q
2. Р.замещения
а) с натрием (этанол и бутанол)2С2Н5ОН + 2Na —> 2С2Н5ОNa + Н2
|
|
|
этилат натрия
б) с галогеноводородами
С2Н5ОН + НBr —> С2Н5Br + Н2О
3. Р. дегидратации
а) С2Н5ОН —> С2Н4 + Н2О
4. Взаимодействует со щелочными металлами с образованием этилатов (или в общем случае — алкоголятов) и водорода.
2C2H5OH + 2К = 2С2Н5ОК + Н2
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена):
Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала, картофеля, риса, кукурузы, источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её схему можно выразить уравнением:
C6H12O6 → 2C2H5OH + 2CO2
В результате брожения получается раствор, содержащий не более 15 % этанола, так как в более концентрированных растворах дрожжи обычно гибнут. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.
Гидратация этилена
В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2=CH2 + H2O → C2H5OH
гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH (этилсерная кислота)
CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4
Применение
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей, двигателей внутреннего сгорания в чистом виде. Ограничено в силу своей гигроскопичности (отслаивается) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов.
|
|
|
Химическая промышленность
Служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
Широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
Является компонентом антифриза и стеклоомывателей.
В бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
В медицине этиловый спирт в первую очередь используется как растворитель, экстрагент и антисептик
по своему действию этиловый спирт можно отнести к антисептикам;
как обеззараживающее и подсушивающее средство, наружно;
подсушивающие и дубящие свойства 96%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
консервант настоек и экстрактов (минимальная концентрация 18 %);
пеногаситель при подаче кислорода, искусственной вентиляции легких;
в согревающих компрессах;
для физического охлаждения при лихорадке (для растирания)[4];
возможно применение как компонента парентерального питания (в виде 5 % раствора) у ослабленных больных с учётом высокой энергетической ценности вещества
компонент общей анестезии в ситуации дефицита медикаментозных средств
Как пеногаситель при отеке легких в виде ингаляции 33 % раствора.
Этанол является противоядием при отравлении некоторыми токсичными спиртами, такими как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты)
|
|
|
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая даже такие как зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является необходимым компонентом спиртных напитков (водка, виски, джин и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,6 до 2,2 %.
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности
49) Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название "фенол". Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
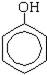
Простейший представитель этого класса — собственно фенол, С6Н5ОН.

фенол
Строение фенола. Одна из двух неподеленных электронных пар атома кислорода втягивается в p-электронную систему бензольного кольца (+M-ЭФФЕКТ группы ОН). Это приводит к двум эффектам: а) увеличивается электронная плотность в бензольном кольце, причем максимумы электронной плотности находятся в орто- и пара-положениях по отношению к группе ОН; б) электронная плотность на атоме кислорода, напротив, уменьшается, что приводит к ослаблению связи О―Н. Первый эффект проявляется в высокой активности фенола в реакциях электрофильного замещения, а второй - в повышенной кислотности фенола по сравнению с предельными спиртами.
|
|
|
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров — орто-, мета- и пара-крезолов:

Физические свойства. Фенолы в большинстве своем — кристаллические вещества (мета-крезол — жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в холодной воде, но хорошо - в горячей и особенно в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения и плавления. Так, собственно фенол представляет собой бесцветные кристаллы с tпл = 41 °С и tкип =182 °С. С течением времени кристаллы краснеют и темнеют.
Химические свойства
1. Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na → 2C6H5ONa + H2
фенолят натрия
C6H5OH + NaOH → C6H5ONa + H2O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
2. Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
а) Реакция с бромной водой (качественная реакция):
 + 3Br2 →
+ 3Br2 →  + 3HBr
+ 3HBr
Образуется 2,4,6-трибромфенол - осадок белого цвета.
б) Нитрование (при комнатной температуре):
C6H5—OH + HNO3(разб.) → H2O + O2N—C6H4—OH (смесь орто- и пара-изомеров)
 + 3HNO3(конц.) → 3H2O +
+ 3HNO3(конц.) → 3H2O + 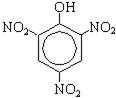
По вторй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
3. Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:

4. Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
Применение фенолов
Фенолы применяются в производстве синтетических смол, пластмасс, полиамидов и других полимеров, лекарственных препаратов, красителей, поверхностно-активных веществ, антиоксидантов, антисептиков, взрывчатых веществ.
Сейчас фенол находит широкое применение при производстве лекарств, красителей, и самый большой объём поступает на производство фенолформальдегидных пластмасс.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2313; Нарушение авторских прав?; Мы поможем в написании вашей работы!