
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Углеводы
|
|
|
|
Классификация углеводов
1. Моносахариды: а) пентозы- рибоза С5Н10О5, дезоксирибоза С5Н10О4
б) гексозы – глюкоза, фруктоза С6Н12О6
2. Дисахариды – сахароза, мальтоза С12Н22О11
3. Полисахариды – крахмал, целлюлоза, гликоген, хитин (С6Н10О5)n
Важнейшим из моносахаридов является глюкоза С6Н12О6, которую иначе называют виноградным сахаром. Это белое кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде. Глюкоза содержится в растительных и живых организмах, в особенности велико ее содержание в виноградном соке (отсюда и название - виноградный сахар), в меде, а также в спелых фруктах и ягодах.
Строение глюкозы выведено на основе изучения ее химических свойств. Так, глюкоза проявляет свойства, присущие спиртам: образует с металлом алкоголяты (сахараты), сложный уксуснокислый эфир, содержащий пять кислотных остатков (по числу гидроксильных групп). Следовательно, глюкоза - многоатомный спирт. С аммиачным раствором оксида серебра она дает реакцию «серебряного зеркала», что указывает на присутствие альдегидной группы на конце углеродной цепи. Следовательно, глюкоза - альдегидоспирт, ее молекула может иметь строение
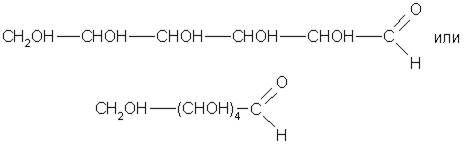
Однако не все свойства согласуются с ее строением как альдегидоспирта. Так, глюкоза не дает некоторых реакций альдегидов. Один гидроксил из пяти характеризуется наибольшей реакционной способностью, и замещение в нем водорода на метальный радикал приводит к исчезновению альдегидных свойств вещества. Все это дало основание сделать вывод, что наряду с альдегидной формой существуют циклические формы молекул глюкозы (α-циклическая и β-циклическая), которые отличаются положением гидроксильных групп относительно плоскости кольца. Циклическое строение молекулы глюкоза имеет в кристаллическом состоянии, в водных же растворах она существует в различных формах, взаимно превращающихся друг в друга:
|
|
|
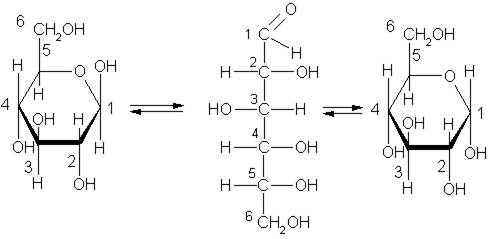
β-циклическая альдегидная α-циклическая
форма форма форма
Как видно, в циклических формах альдегидная группа отсутствует. Гидроксильная группа, стоящая у первого углеродного атома, наиболее реакционноспособная. Циклической формой углеводов объясняются их многие химические свойства.
В промышленном масштабе глюкозу получают гидролизом крахмала (в присутствии кислот). Освоено также ее производство из древесины (целлюлозы).
Глюкоза - ценное питательное вещество. При окислении ее в тканях освобождается энергия, необходимая для нормальной жизнедеятельности организмов. Реакцию окисления можно выразить суммарным уравнением:
C6H12O6 + 6О2 → 6CO2 + 6H2O
Глюкоза применяется в медицине для приготовления лечебных препаратов, консервирования крови, внутривенного вливания и т. д. Она широко применяется в кондитерском производстве, в производстве зеркал и игрушек (серебрение). Ею пользуются при крашении и аппретировании тканей и кож.
58) Сахароза C12H22O11, или свекловичный сахар, тростниковый сахар, в быту просто сахар — дисахарид, состоящий из двух моносахаридов — α-глюкозы и β-фруктозы.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
Сахароза имеет высокую растворимость.
Сахароза подвергается гидролизу - разложению в присутствии минеральной кислоты и повышенной температуре на глюкозу и фруктозу.
С12Н22О11 + Н2О→ С6Н12О6 + С6Н12О6
сахароза фруктоза глюкоза
Применение:
|
|
|
- в качестве продукта питания,
- в кондитерской промышленности,
- для получения искусственного мёда (гидролиз сахарозы).
59) Крахмал – полисахарид, молекулы которого состоят из повторяющих глюкозных остатков, соединённых по α-1,4 (в линейной части) или α-1,6 связям (в точках ветвления).
Безвкусный, аморфный порошок белого цвета, нерастворимый в холодной воде. Под микроскопом видно, что это зернистый порошок; при сжатии порошка крахмала в руке он издаёт характерный «скрип», вызванный трением частиц.
Крахмал является основным резервным веществом большинства растений. Он образуется в клетках зелёных частей растения и накапливается в семенах, клубнях, луковицах и пр.
Часть глюкозы, образующейся в зелёных растениях при фотосинтезе, превращается в крахмал:
6CO2 + 6H2O → C6H12O6 + 6O2
nC6H12O6(глюкоза) → (C6H10O5)n + nH2O
В общем виде это можно записать как
6nCO2 + 5nH2O → (C6H10O5)n+ 6nO2.
При действии ферментов или нагревании с кислотами подвергается гидролизу.
УравнениеLC6H10O5)n + nH2O—H2SO4→ nC6H12O6.
Качественные реакции:
1. Крахмал, в отличие от глюкозы, не даёт реакции серебряного зеркала.
2. Подобно сахарозе, не восстанавливает гидроксид меди (II).
3. Взаимодействие с йодом (окрашивание в синий цвет) — качественная реакция;
Крахмал, являясь одним из продуктов фотосинтеза, широко распространен в природе. Для растений он является запасом питательных веществ и содержится в основном в плодах, семенах и клубнях. Наиболее богато крахмалом зерно злаковых растений: риса (до 86 %), пшеницы (до 75 %), кукурузы (до 72 %), а также клубни картофеля (до 24 %).
Для организма человека крахмал наряду с сахарозой служит основным поставщиком углеводов — одного из важнейших компонентов пищи. Под действием ферментов крахмал гидролизуется до глюкозы, которая окисляется в клетках до углекислого газа и воды с выделением энергии, необходимой для функционирования живого организма.
Раствор крахмала в воде является неньютоновской жидкостью.
60) Целлюлоза состоит из остатков молекул глюкозы, которая и образуется при кислотном гидролизе целлюлозы:
(C6H10O5)n + nH2O → nC6H12O6
Мягкая часть растений и животных в основном содержит целлюлозу. Именно целлюлоза придает растениям гибкость.
|
|
|
Практически все зеленые растения вырабатывают целлюлозу для своих потребностей. В ее состав входят те же элементы, что и в сахар, а именно: углерод, водород и кислород. Эти элементы присутствуют в воздухе и воде. Сахар образуется в листьях и, растворяясь в соке, распространяется по всему растению. Основная часть сахара идет на содействие росту растений и на восстановительные работы, остальной сахар превращается в целлюлозу. Растение использует ее для создания оболочки новых клеток.
Целлюлоза — один из тех естественных продуктов, которые практически невозможно получить искусственно. Но мы используем ее в различных областях. Человек получает целлюлозу из растений даже после их отмирания и полного отсутствия в них влаги. Например, дикий хлопок — эта одна из самых чистых форм натуральной целлюлозы, которую человек использует при изготовлении одежды.
Целлюлоза входит в состав растений, применяемых человеком в качестве продуктов питания — салата, сельдерея, а также отрубей. Организм человека не в состоянии переварить целлюлозу, однако она полезна как «грубые корма» в его диете. В желудке некоторых животных, например овец, верблюдов, имеются бактерии, которые позволяют этим животным переваривать целлюлозу.
Целлюлоза является ценным сырьем, из которого человек получает различные изделия. Хлопок, на 99,8% состоящий из целлюлозы, представляет собой замечательный пример того, что человек может произвести из целлюлозного волокна. Если хлопок обработать смесью азотной и серной кислоты, мы получим пироксилин, являющийся взрывчатым веществом.
После различной химической обработки целлюлозы из нее можно получить и другие изделия. Среди них: основа для фотопленки, добавки для лаков, волокна вискозы для производства тканей, целлофан и другие пластические материалы. Целлюлоза также применяется при изготовлении бумаги.
Искусственные волокна (нити) - это химические волокна (нити), получаемые химическим превращением природных органических полимеров (например, целлюлозы, казеина, протеинов или морских водорослей).
|
|
|
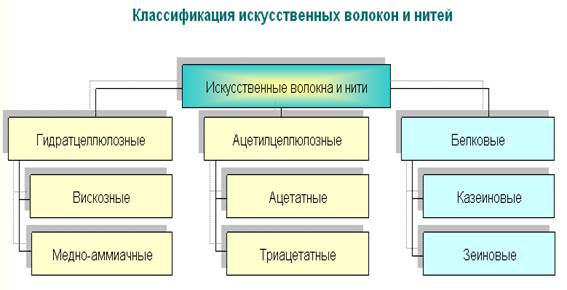
Искусственные волокна получают из полимеров, встречающихся в природе в готовом виде (целлюлоза, белки). Например, вискоза, это та же целлюлоза, что и в хлопке. Только вискозу прядут из древесных волокон. Чтобы получить из "дров" мягкие нити, необходимы разные химические процессы.
61) Амины - органические производные аммиака, в молекулах которого один, два или все три атома водорода замещены органическими радикалами.
По числу радикалов амины делятся на первичные, вторичные и третичные.
Общая формула первичных аминов: 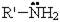
Общая формула вторичных аминов: 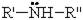
Общая формула третичных аминов: 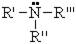
По типу простейших радикалов амины делятся на предельные, непредельные и ароматические:
Предельный амин: Непредельный амин: Ароматический амин:
CH3—CH2—NH2 CH2=CH—CH2—NH2 C6H5—NH2
этиламин (аминоэтан) аллиламин (3-аминопропен-1) фениламин
(анилин)
У атома азота в молекулах аминов есть неподеленная пара электронов, которая может участвовать в образовании связи по донорно-акцепторному механизму.
В ряду
анилин→ аммиак → первичный амин →вторичный амин →третичный амин
электронная плотность на атоме азота возрастает.
Из-за наличия в молекулах неподеленной пары электронов амины, как и аммиак, проявляют основные свойства. В ряду
Анилин → аммиак → первичный амин → вторичный амин
основные свойства усиливаются, из-за влияния типа и числа радикалов.
Физические свойства. Простейшие амины - газы с запахом аммиака, более сложные - жидкости с запахом рыбы, высшие - твердые нерастворимые в воде вещества. Температуры кипения и растворимость в воде у аминов меньше, чем у соответствующих спиртов.
Химические свойства
1) Горение:
4CH3NH2 + 9O2 → 4CO2 + 10H2O +2N2
2) Взаимодействие с водой:
CH3NH2 + H2O ↔ CH3NH3+ + OH-
Взаимодействие с кислотами (основные свойства):
2CH3NH2 + H2SO4 →(CH3NH3)2SO4
сульфат метиламмония
Получение аминов:
Наиболее общим методом получения первичных аминов является восстановление нитросоединений:
1. Нагревание галогеналканов с аммиаком:
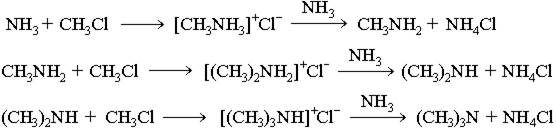
В основе этих превращений лежит реакция нуклеофильного замещения галогена в галогеналканах. Роль нуклеофила играют молекулы аммиака и аминов, имеющие неподеленную пару электронов на атоме азота.
62) Анилин -представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Химические свойства
1) 4C6H5NH2 + 31O2 → 24CO2 + 14H2O + 2N2
2) Анилин с водой практически не реагирует.
3) C6H5NH2 + HCl →(C6H5NH3)Cl
хлорид фениламмония
4) Реакции замещения в ароматических аминах (реакция анилина с бромной водой или с азотной кислотой):
 + 3Br2 →
+ 3Br2 → 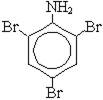 + 3HBr
+ 3HBr
В этих реакциях (бромирование и нитрование) преимущественно образуются орто- и пара-производные.
Получение анилина:
C6H5NO2 + 6[H] →C6H5NH2 + 2H2O.
В промышленности эта реакция протекает при нагревании нитробензола с водяным паром в присутствии железа. В лаборатории водород "в момент выделения" образуется по реакции цинка со щелочью или железа с соляной кислотой. В последнем случае образуется хлорид анилина. Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые в 1842 г.
Применение
Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), гербицидов, искусственных каучуков.
63) Аминокислоты - органические вещества, в молекулах которых содержатся две функциональные группы: аминогруппа и карбоксильная группа.
Общая формула молекул аминокислот - NH2—R—COOH, где R - двухвалентный радикал.
Общая формула предельных аминокислот с одной карбоксильной и одной аминогруппой - CnH2n+1NO2.
Физические свойства: бесцветные кристаллические вещества с температурами плавления 150 - 250oС, хорошо растворимы в воде (лучше, чем в органических растворителях), многие - сладкие.
Изомерия аминокислот
1. Изомерия углеродного скелета
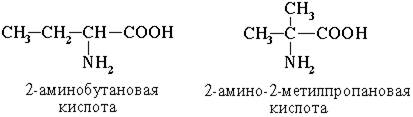
2. Изомерия положения функциональных групп
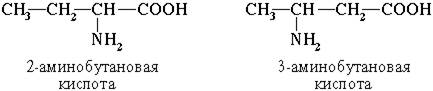
3. Оптическая изомерия
Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (α-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).
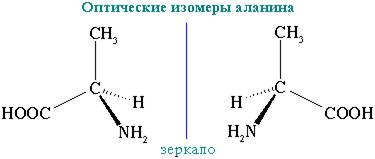
Оптическая изомерия природных α-аминокислот играет важную роль в процессах биосинтеза белка.
Химические свойства
Горение:
1) 4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2
2) Взаимодействие с водой:
NH2CH2COOH + H2O ↔ +NH3CH2COOH + OH-
Аминокислоты - амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
3) Реакции с растворами щелочей:
NH2CH2COOH + NaOH ↔ NH2CH2COO—Na+ + H2O (NH2CH2COONa -аминоацетат натрия)
4) Реакции с растворами кислот:
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4 (сульфат глициния)
5) Этерификация:NH2CH2COOH + C2H5OH↔NH2CH2COOC2H5 + H2O (упрощенное уравнение реакции)
Аминокислоты и их производные используются в качестве лекарственных средств в медицине. Так глицин оказывает укрепляющее действие на организм и стимулирует работу мозга. Лизин и метионин применяются в качестве добавок в корм сельскохозяйственным животным. Аминокислоты являются основными составными частями и строительными элементами белковой молекулы.
Молекула белка построена из 100 или более остатков аминокислот, ковалентно связанных в полимерные цепи. В человеческом организме 5 миллионов белков, причем ни один из белков человека не идентичен с белком любого другого живого организма.
Несмотря на такое разнообразие белковых структур для их построения необходимы всего 22 аминокислоты. Незаменимые аминокислоты, их всего 9, должны поступать с пищей человека, они не синтезируются в организме человека, остальные аминокислоты могут образовываться в нашем организме из других аминокислот.
Биологические функции белков очень разнообразны. Они выполняют каталитические, регуляторные, структурные, двигательные, транспортные, защитные, запасные и другие функции. Белки составляют основу биомембран, важнейшей составной части клетки и клеточных компонентов.
Исключительное свойство белка - самоорганизация структуры, то есть способность самопроизвольно создавать определенную свойственную только данному белку структуру. Для того, чтобы организм мог эффективно использовать и синтезировать белок, должны присутствовать все незаменимые аминокислоты и в необходимой пропорции. Даже временное отсутствие одной незаменимой аминокислоты может отрицательно сказаться на синтезе белка. При уменьшении количества любой незаменимой аминокислоты или ее отсутствии пропорционально уменьшается эффективность всех остальных.
Многие факторы играют роль в появлении дефицита незаменимых аминокислот, даже при сбалансированном питании. Пониженная абсорбция, стресс, инфекции, травмы, химиотерапия, возраст и другие причины - все это может сказаться на дефиците незаменимых аминокислот в организме.
Помимо 22 аминокислот, входящих в состав белков, известно свыше 150 других, которые встречаются в различных клетках и тканях либо в свободном, либо в связанном виде, но никогда не встречаются в составе белков.
Значение аминокислот не ограничивается их ролью в синтезе тканевых белков. Каждая из них выполняет в организме свои особые функции, направленные на поддержание гомеостаза организма.
64) Белки – это сложные высокомолекулярные природные соединения, построенные из -аминокислот. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот.Составляют основу жизнедеятельности всех органов. Различают простые (протеины) и сложные (протеиды) белки.
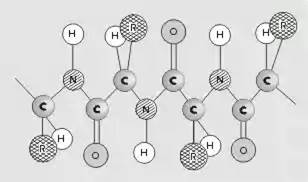
Первичная структура белка – последовательность чередования аминокислотных остатков (все связи ковалентные, прочные) (рис. 1).
Рис. 1.
Первичная структура белка
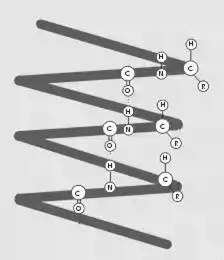
Вторичная структура – форма полипептидной цепи в пространстве. Белковая цепь закручена в спираль (за счет множества водородных связей) (рис. 2).
Рис. 2.
Вторичная структура белка
Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи) (рис. 3).
Рис. 3.
Третичная структура белка

Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс (рис. 4).
Рис. 4.
Четвертичная структура белка

Химические свойства белков
1) При нагревании белков и пептидов с растворами кислот, щелочей или при действии ферментов протекает гидролиз. Гидролиз белков сводится к расщеплению полипептидных связей:
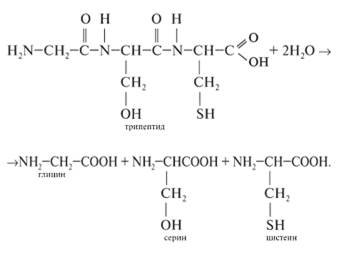
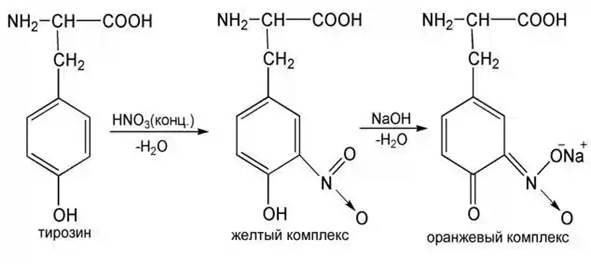
2) Ксантопротеиновая реакция (качественная реакция)
65) ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ – в составе углеводородного цикла они содержат один или несколько гетероатомов: O, N, S
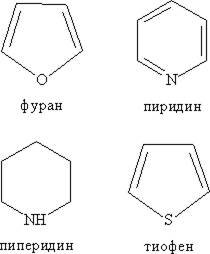
Шестичленные гетероциклические соединения с одним гетероатомом.
Пиридин. По электронному строению пиридин напоминает бензол. Все атомов углерода и атом азота находятся в состоянии sp2-гибридизации. Если в молекуле бензола заменить группу СН на атом азота, мы получим пиридин.
Пиридин – бесцветная жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях. Ядовит.
Пиридин входит в каменноугольную смолу. Система пиридина входит в состав многих витаминов.
Никотин – бесцветное масло с запахом табака, растворяется в воде. Ядовит. Летальная доза для человека – 40 мг. В малых дозах возбуждает нервную систему, повышает давление. В больших дозах вызывает паралич нервной системы.
Шестичленные гетероциклические соединения с двумя гетероатомами.
Пиримидин C4H4N2 – шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на два атома азота. Напишите структурную формулу пиримидина.
Используют пиримидин в органическом синтезе.
Его важнейшими производными являются урацил, тимин, цитозин.
Пятичленные гетероциклические соединения с одним гетероатомом.
Фуран - C4H4O. бесцветная жидкость с запахом хлороформа. Растворяется в спирте. При хранении темнеет.
66) К нуклеиновым кислотам относят высокополимерные соединения, распадающиеся при гидролизе на пуриновые и пиримидиновые основания, пентозу и фосфорную кислоту. Нуклеиновые кислоты содержат углерод, водород, фосфор, кислород и азот. Различают два класса нуклеиновых кислот: рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК).
Строение и функции ДНК
ДНК — полимер, мономерами которой являются дезоксирибонуклеотиды. Модель пространственного строения молекулы ДНК в виде двойной спирали была предложена в 1953 г. Дж. Уотсоном и Ф. Криком.
Молекула ДНК образована двумя полинуклеотидными цепями, спирально закрученными друг около друга и вместе вокруг воображаемой оси, т.е. представляет собой двойную спираль.
Мономер ДНК — нуклеотид (дезоксирибонуклеотид) — состоит из остатков трех веществ: 1) азотистого основания, 2) пятиуглеродного моносахарида (пентозы) и 3) фосфорной кислоты. Азотистые основания нуклеиновых кислот относятся к классам пиримидинов и пуринов. Пиримидиновые основания ДНК (имеют в составе своей молекулы одно кольцо) — тимин, цитозин. Пуриновые основания (имеют два кольца) — аденин и гуанин. Моносахарид нуклеотида ДНК представлен дезоксирибозой.
Функция ДНК — хранение и передача наследственной информации.
РНК — полимер, мономерами которой являются рибонуклеотиды. В отличие от ДНК, РНК образована не двумя, а одной полинуклеотидной цепочкой (исключение — некоторые РНК-содержащие вирусы имеют двухцепочечную РНК). Нуклеотиды РНК способны образовывать водородные связи между собой. Цепи РНК значительно короче цепей ДНК.
Мономер РНК — нуклеотид (рибонуклеотид) — состоит из остатков трех веществ: 1) азотистого основания, 2) пятиуглеродного моносахарида (пентозы) и 3) фосфорной кислоты. Азотистые основания РНК также относятся к классам пиримидинов и пуринов.
Пиримидиновые основания РНК — урацил, цитозин, пуриновые основания — аденин и гуанин. Моносахарид нуклеотида РНК представлен рибозой.
Выделяют три вида РНК: 1) информационная (матричная) РНК — иРНК (мРНК), 2) транспортная РНК — тРНК, 3) рибосомная РНК — рРНК.
Все виды РНК представляют собой неразветвленные полинуклеотиды, имеют специфическую пространственную конформацию и принимают участие в процессах синтеза белка.
Функции тРНК: 1) транспорт аминокислот к месту синтеза белка, к рибосомам, 2) трансляционный посредник.
Функции рРНК: 1) необходимый структурный компонент рибосом и, таким образом, обеспечение функционирования рибосом; 2) обеспечение взаимодействия рибосомы и тРНК; 3) первоначальное связывание рибосомы и кодона-инициатора иРНК и определение рамки считывания, 4) формирование активного центра рибосомы.
Функции иРНК: 1) перенос генетической информации от ДНК к рибосомам, 2) матрица для синтеза молекулы белка, 3) определение аминокислотной последовательности первичной структуры белковой молекулы.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1467; Нарушение авторских прав?; Мы поможем в написании вашей работы!