
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакционная способность предельных углеводородов. Механизм реакции свободнорадикального замещения. Галогенирование, сульфирование, нитрование. Окисление
|
|
|
|
Реакционная способность непредельных углеводородов. Механизм реакции электрофильного присоединения к алкенам. Влияние статических и динамических факторов на региоселективность реакций.
Понятие о квантовой хромодинамике.
Виды фундаментальных взаимодействий. Классификация элементарных частиц.
Ядерные реакции. Закон сохранения. Энергетический выход.
Теория Дебая теплоемкости решетки. Фотоны.
Теплоемкость кристаллической решетки. Закон Дюлонга и Пти.
Электропроводность проводников. Примесная электропроводность.
(47). Состав и характеристика атомного ядра.
(48). Энергия связи ядра. Удельная энергия связи. Выделение энергии при делении ядер и при термоядерных реакциях.
(49). Ядерные силы, их характеристики и природа.
(50). Радиактивность. Закон радиоактивного распада. Период полураспада.
51.Виды радиоактивности. Закономерность ß-распада, α-распада.
(53). Элементарная частица. Античастицы. Виды фундаментальных взаимодействий.
Благодаря электронам π-связи в молекулах алкенов имеется область повышенной электронной плотности, поэтому они склонны подвергаться атаке электрофильными реагентами. Относительно плоскости π-связи одинаковые заместители у двух атомов углерода могут располагаться по одну (цис) или по разные (транс) стороны. Это приводит к существованию в ряду алкенов пространственных изомеров (стереоизомеров), известных под названием цис- и транс-изомеров. Основная причина существования цис- и транс -изомеров заключается в невозможности вращения вокруг π-связи без ее нарушения.


Общее описание механизма реакции электрофильного присоединения AE. Присоединение к алкенам электрофильных реагентов НХ (Н2О, ННа1 и т.п.) протекает по гетеролитическому механизму. Электрофильной частицей в данном процессе служит простейший электрофил - протон.
|
|
|
В реакции выделяют две основные стадии:
• атаку алкена протоном с образованием карбокатиона (медленная стадия, определяющая скорость процесса в целом);
• атаку образовавшегося карбокатиона нуклеофилом; в реакции гидратации это молекула Н2О (быстрая стадия).
Так, при гидратации пропена (несимметричного алкена) в соот ветствии с правилом Марковникова преимущественным продукто реакции является пропанол-2:
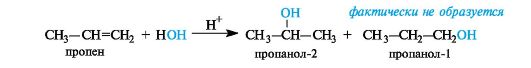
Такое направление реакции объясняется совокупностью двух факторов. В статическом, т. е. нереагирующем, состоянии в несимметричных алкенах электронная плотность π-связи смещена под влиянием заместителя. Возникшие частичные заряды определяют место будущей атаки протоном. В пропене таким местом будет атом С-1 с частичным отрицательным зарядом (как следствие +/-эффекта метильной группы). Таким образом, статический фактор благоприятствует элек-
трофильной атаке по группе СН2 (путь а), что приводит к вторичному карбокатиону (I). При атаке по атому С-2 должен был бы образоваться менее стабильный первичный карбокатион (II) (путь б).
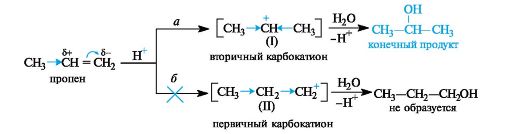
В динамическом состоянии, т. е. в ходе реакции, из двух возможных карбокатионов (I) или (II) будет образовываться более устойчивый. Во вторичном карбокатионе положительно заряженный атом угле- рода связан с двумя электронодонорными алкильными группами, в первичном - с одной. В результате во вторичном карбокатионе за счет +/-эффекта двух алкильных групп осуществляется более эффективное уменьшение положительного заряда. Таким образом, качественная оценка относительной устойчивости промежуточных частиц также говорит в пользу образования вторичного карбокатиона (путь а).
Правило Марковникова применяется без оговорок только к алкенам. Однако ненасыщенные соединения часто содержат при двойной связи электроноакцепторные группы (карбоксильную, альдегидную и др.). Учитывая поляризацию связи С=С под влиянием заместителя (статический фактор), можно предсказать иной характер присоединения, а именно, против правила Марковникова. Например, при гидратации α,β-ненасыщенных карбоновых кислот в сильно кислой среде образуются β-гидроксикарбоновые кислоты.
|
|
|
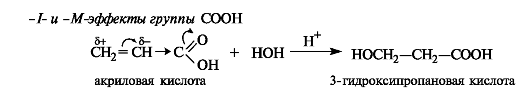
Присоединение галогеноводородов и серной кислоты. Алкены и циклоалкены в достаточно мягких условиях взаимодействуют с галогеноводородами, серной и другими сильными кислотами, способными к диссоциации с образованием протона.В результате присоединения галогеноводородов образуются галогенопроизводные алканов и циклоалканов.

В реакции с концентрированной серной кислотой алкены образую гидросульфаты, в результате гидролиза которых получаются спирты.

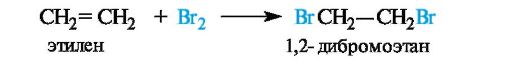
Галогенирование. Алкены в обычных условиях легко присоединяют галогены. Так, быстрое обесцвечивание бромной воды без выделения бромоводорода служит качественной пробой на двойную связь. Еще легче проходит присоединение хлора.
Восстановление и окисление связей C=C. Восстановление двойных связей алкенов осуществляется каталитическим гидрированием - присоединением водорода в присутствии металлов (никеля - при нагревании, платины или палладия - при обычной температуре). Результатом является образование насыщенного продукта - алкана (отсюда, кстати, и возникли термины «насыщенные» и «ненасыщенные» соединения).
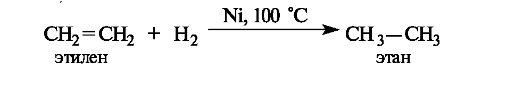
Окисление двойных углерод-углеродных связей в зависимости от условий может приводить к эпоксидам, 1,2-диолам (гликолям) или карбонильным соединениям - продуктам расщепления двойной связи.

Окисление р-ом KMnO4 в нейтр. или слабощелочной среде (реакция Вагнера):
3 CH3=CH2 + 2 KMnO4 = 3 CH2OH-CH2OH + 2 MnO2 + 2 KOH (обесцвечивание KMnO4)
Окислительное расщепление кислотным р-ом KMnO4 или K2Cr2O7, O3(озон):

Правило Марковникова:
При присоединении протонных кислот или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрированному атому углерода.
Инертны при обычных условиях:
1) Не способны к реакциям присоединения
|
|
|
2) С большинством хим. реагентов не реагируют или мало
3) Реакции замещения при наличии высокой температуры или облучении:
· Окисление O2, галогенами, HNO3, сульфоокисление.
· Изомеризация
· Пиролиз
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2556; Нарушение авторских прав?; Мы поможем в написании вашей работы!