
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энергии Гиббса как критерий самопроизвольного течения процесса
|
|
|
|
Третий закон термодинамики.
Энтропия идеального кристалла при 0град. К равна S=0.
Идеальный – кристалл, в котором атомы занимают узлы кристаллической решетки в строгом соответствии с геометрическими законами, т.е. одно возможное микросостояние реализует одно макросостояние.
Энтропия идеального кристалла при 0град.К служит точкой отсчета в шкале энтропии.
В химических процессах одновременно действуют два противоположных фактора — энтропийный (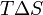 ) и энтальпийный (
) и энтальпийный (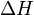 ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (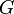 ):
):

Из этого выражения следует, что 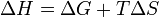 , то есть некоторое количество теплоты расходуется на увеличение энтропии (
, то есть некоторое количество теплоты расходуется на увеличение энтропии (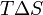 ), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (
), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (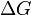 ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 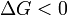 процесс может протекать, при
процесс может протекать, при  процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же  , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 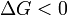 (по кинетическим причинам).
(по кинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса 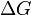 в ходе химической реакции с её константой равновесия
в ходе химической реакции с её константой равновесия 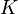 :
:
|
|
|
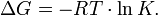
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
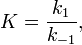
где 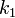 — константа скорости прямой реакции,
— константа скорости прямой реакции, 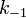 — константа скорости обратной реакции.
— константа скорости обратной реакции.
9,10. Расчет константы равновесия по закону действующих масс. Химическое равновесие….
Рассмотрим гомогенную газообразную реакцию
T=const
aA+bB Û dD+eE
 |
Kp=
Закон действия масс: Кр равна произведению парциального давления продуктов реакций на произведение парциальных давлений исходных веществ, в степенях, равных стехиометрическим коэффициентам.
Для жидкостей и растворов:
 |
 Kp=
Kp=
Для реакций, протекающих с лева на право К>>1
Если величина DG показывает направление процесса, то Кр показывает, как глубоко протекает этот процесс.
|
Kp=e
9. Химическое равновесие. Расчет константы равновесия по термодинамическим данным: ∆H, ∆S, ∆G
11. Химическая кинетика. Раздел физической химии, изучающий протекание процесса во времени.

По изменению концентрации за определенный интервал времени:
Vср = (C2-C1)/(t2-t1)
V=Dn/(DS*Dt) – n-изменение числа молей; S-поверхность раздела масс.
Основным постулатом в формальной кинетике является закон действующих масс.
aA+bB Û dD+eE
Скорость реакции прямо пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
V=K*CAa*CBb
V=K*CDd*CEe
Физический смысл константы скорости – скорость реакции, если концентрация равна 1.
Различают: моно; би; три; - по числу молекул, участвующих в элементарном акте химического взаимодейтсвия.
1) H2O2=H2O+1/2O2
2) H2+Cl2=2HCl
3) 2NO+O2=2NO2
Порядок реакции обозначается n, определяется суммой показателей степеней в законе действующих масс.
n=a+b
aA+bB Û dD+eE
|
|
|
V=K*CAa*CBb
V=K*CDd*CEe
Для элементарных реакций, которые протекают в одну стадию, порядок и молекулярность совпадают.
Изучение порядка реакции позволяет определить механизм реакции (в 1 стадию или несколько).
Правило Вант-Гоффа
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C).Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:

где  — скорость реакции при температуре
— скорость реакции при температуре 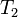 ,
, 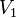 — скорость реакции при температуре
— скорость реакции при температуре  ,
, 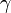 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
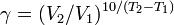
Энергия Активации
В ходе химической реакции взаимодействия продукты образуются не сразу после столкновения исходных веществ, а сначала образуется промежуточный комплекс. Это реальная молекула, в которой старые связи ещё не совсем разорвались, а новые связи не совсем образованы.
При распаде активированного комплекса образуются продукты реакции. Т.о. энергия активации – это энергия, которая затрачивается на образование активного комплекса.
Уравнение Аррениуса
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции 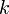 от температуры
от температуры 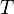 .
.
Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации  ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией 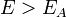 , пропорционально
, пропорционально  . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
|
|
|
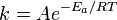
Здесь 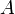 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул,  — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений 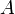 зависит от температуры, но эта зависимость достаточно медленная:
зависит от температуры, но эта зависимость достаточно медленная:

Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений 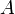 на 10 %.
на 10 %.
В рамках теории активированного комплекса получаются другие зависимости 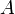 от температуры, но во всех случаях более слабые, чем экспонента.
от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
12. Растворы электролитов
Электролиты – вещества, растворы и расплавы которых проводят электрический ток.
Закон Рауля можно использовать и для электролитов, если ввести поправочный коэффициент:
i – изотермический
Коэффициент показывает во сколько раз температура кипения раствора электролита выше, чем температура кипения, рассчитанная по закону Рауля.
i = DTкип.электр/DTкип.теор. = DTзамерз.электр/DTзамерз.теор
NaCl – i=2
DTкип=i*E*m
DTзамерз=i*K*m
Для электролитов этот коэффициент связан со степенью диссоциации a. – это отношение числа молекул распавшихся на ионы, к первоначальному числу молекул.
a=i-1/n-1 n – число частиц, на которое распался электролит.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1344; Нарушение авторских прав?; Мы поможем в написании вашей работы!