
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свободная энергия Гиббса
|
|
|
|
Закон разведения Освальда.
Если первоначальная концентрация электролита C0, а степень диссоциации a, то
Kд= C0a2/1-a
Для слабых электролитов: 1-a» 1
Kд» C0a2
 a= Ö(Kд/ C0)
a= Ö(Kд/ C0)
Закон Рауля: относительное понижение P01 (давление насыщенного пара раствора над читсым растворителем) прямо пропорционально мольной доле растворенного вещества.
13.Аналитический и графический расчет энергии активации.
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации.
Графический метод: по опытным данным строят график зависимости 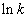 от
от  , если всё верно, получается прямая (типа\), тангенс угла наклона
, если всё верно, получается прямая (типа\), тангенс угла наклона 
Аналитический метод: положим, что в небольшом интервале Т энергия активации постоянна.
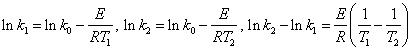

Энтрапия является критерием самопроизвольного течения процесса только в изолированных системах. На практике надо знать критерии, описывающие реальные процессы.
Рассмотрим изотермический процесс в закрытой системе.
| Обратимый процесс | Необратимый процесс |
| DS=Qобр./T p=const Qp=DH DH-TDS=0 DG=0 DG=DH-TDS | DS=Qнеобр./T p=const DH-TDS<0 DG<0 |
Таким образом в закрытой системе все самопроизвольно протекающие процессы идут с уменьшением энергии Гиббса.
Условия равновесия DG=0
Условия самопроизвольного течения реакции DG<0
Все системы самопроизвольно стремятся к равновесию.
 |
Изменение энергии Гиббса – движущая сила процесса.
HF*
Физический смысл изменения энергии Гиббса: -DG=Amax, максимально полезная работа, которая совершает система.
Все самопроизвольно протекающие процессы стремятся понизить запас своей энергии, то есть интальпия характеризует стремление к укрупнению частиц, образованию более крупных молекул.
|
|
|
Энтрапия – стремление системы к образованию более мелких частиц.
DG – равнодействующая двух противоположных процессов. Для химической реакции:
DG0=ånjDG0обр.прод.-åniDG0обр.исх.в-в
15.Электрохимия
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 468; Нарушение авторских прав?; Мы поможем в написании вашей работы!