
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванический элемент Якоби-Даниэля. Расчет эдс гальванических элементов, составленных из электродов 1 рода
|
|
|
|
Электролиз. Законы Фарадея. Катодное нанесение покрытий и анодное растворение металла
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорционально эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
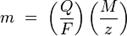
Где:
m — масса осаждённого на электроде вещества в граммах
Q — полный электрический заряд, прошедший через вещество
F = 96,485 C mol−1 — постоянная Фарадея
M — молярная масса вещества
z — валентное число ионов вещества (число электронов на один ион).
Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m.
Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Катодное нанесение покрытий и анодное растворение металла
Цинк лучше растворяется в растворах своих солей то есть легче отдает ионы в раствор, чем медь, и поэтому он заряжается отрицательно. На поверхности цинка будет находиться избыток электронов. В то же время медь, обладая меньшей скоростью растворения, заряжается положительно, так как скорость перехода ионов из раствора на поверхность меди больше, чем скорость перехода ионов меди с пластинки в раствор. На поверхности пластинки в результате этого возникает недостаток электронов - пластинка заряжается положительно (рис.1). Если соединить эти пластинки проводником (например, медной проволокой), то избыточная часть электронов, имеющихся в цинке, будет переходить на медную пластинку это приводит к понижению заряда цинковой пластинки и нарушает равновесие двойного электрического слоя. Для восстановления равновесия двойного слоя с пластинки в раствор будет переходить определенное количество цинка. При переходе избыточных электронов с цинковой пластинки на медную положительный заряд последней будет уменьшаться. Для сохранения равновесия в двойном электрическом слое часть положительных ионов из раствора будет выделяться на медной пластинке.
|
|
|
Таким образом, разность в зарядах пластинки, обусловленная переходом электронов с цинковой пластинки на медную, будет восстанавливаться.
В результате возникает самопроизвольно протекающий процесс, сопровождающийся растворением цинковой пластинки и выделением на медной пластинке положительно заряженных ионов меди и их разрядкой. Это направленное течение электронов по проводнику и представляет электрический ток, который можно измерить при помощи соответствующих приборов.
Электрический ток, определяемый разностью потенциалов между электродами в таких обратимых условиях их работы, называется электродвижущей силой элемента.
На основании теоретических расчетов установлено, что величина электродного потенциала, возникающая на границе между металлом и раствором соли этого металла, то есть раствором, содержащим ионы этого металла, равна:

где Е0 - постоянная, характерная для данного металла; R - газовая постоянная, равная 8,32 Дж/град•моль; Т - абсолютная температура; n - степень окисления металла в данном соединении, то есть число электронов, которое теряет атом металла, превращаясь в ион; F - число Фарадея, равное 96500 Кл; α - активная молярная концентрация ионов металла в данном растворе.
|
|
|
Это уравнение выражает зависимость потенциала металла от концентрации его ионов в растворе и называется уравнением электродного потенциала, известным под названием уравнения Нернста.
ЭДС гальванического элемента, составленного из любой пары электродов, можно вычислить по разности потенциалов электродов, если пренебречь потенциалом, возникающим на границе раздела двух растворов (этот потенциал называется диффузионным); он по своей величине много меньше электродных потенциалов.
ЭДС принято выражать положительной величиной. Например, в медно-цинковом гальваническом элементе
Cu | CuSO4 || ZnSO4 | Zn
раствор раствор
цинк - отрицательный электрод, а медь - положительный. Нормальный потенциал цинка при 25° С равен -0,76 В. Нормальный потенциал меди при 25°С равен +0,34 В. ЭДС медно-цинкового гальванического элемента равна (+0,337) - (-0,763) = + 1,10 (В), то есть:
Eo = ECu - EZn = Eo
(Cu2+/Cu) - Eo (Zn2+/Zn) = +0.337 - (-0.763) = +1.100 В.
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1121; Нарушение авторских прав?; Мы поможем в написании вашей работы!