
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства. Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов
|
|
|
|
Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения иреакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
11. Реакции электрофильного присоединения по двойной связи алкенов
Граничными орбиталями ВЗМО и НСМО алкенов являются занятая  - и пустая
- и пустая  *-орбитали. Следовательно, в реакциях с электрофилами (Е+) будет участвовать
*-орбитали. Следовательно, в реакциях с электрофилами (Е+) будет участвовать  -орбиталь, а в реакциях с нуклеофилами (Nu-) -
-орбиталь, а в реакциях с нуклеофилами (Nu-) -  *-орбиталь связи С=С (см. рис. 3). В большинстве случаев простые алкены легко вступают в реакции с электрофилами, а с нуклеофилами реагируют с большим трудом. Это объясняется тем, что обычно НСМО большинства электрофилов по энергии близки к энергии
*-орбиталь связи С=С (см. рис. 3). В большинстве случаев простые алкены легко вступают в реакции с электрофилами, а с нуклеофилами реагируют с большим трудом. Это объясняется тем, что обычно НСМО большинства электрофилов по энергии близки к энергии  -ВЗМО алкенов, тогда как ВЗМО большинства нуклеофилов лежат значительно ниже
-ВЗМО алкенов, тогда как ВЗМО большинства нуклеофилов лежат значительно ниже  *-НСМО.
*-НСМО.
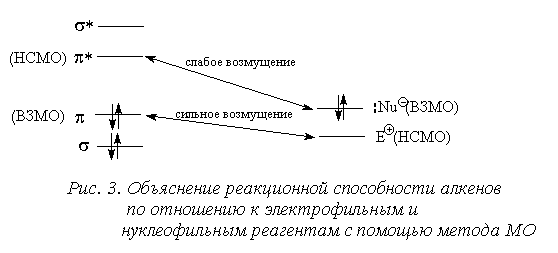
Простые алкены реагируют лишь с очень сильными нуклеофильными агентами (карбанионы) в жестких условиях, однако введение электроноакцепторных групп в алкены, например, NO2, COR и др., приводит к понижению  *-уровня, благодаря чему алкен приобретает способность реагировать с нуклеофилами средней силы (аммиак, RO-, Nє C-, енолят-анион и т. д.).
*-уровня, благодаря чему алкен приобретает способность реагировать с нуклеофилами средней силы (аммиак, RO-, Nє C-, енолят-анион и т. д.).
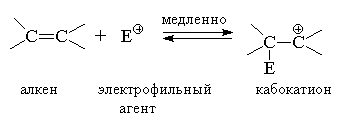
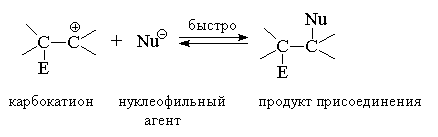
В результате взаимодействия электрофильного агента Е+ с алкеном образуется карбокатион, обладающий высокой реакционной способностью. Карбокатион далее стабилизируется за счет быстрого присоединения нуклеофильного агента Nu-:
|
|
|
Поскольку медленной стадией является присоединение электрофила, то процесс присоединения любого полярного агента Е+  Nu-
Nu- 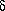 следует рассматривать именно как электрофильное присоединение к кратной связи алкена. Известно большое число реакций этого типа, где роль электрофильного агента выполняют галогены, галогеноводороды, вода, соли двухвалентной ртути и другие полярные реагенты. Электрофильное присоединение к двойной связи в классификации механизмов органических реакций имеет символ АdE(Addition Electrophilic) и в зависимости от числа реагирующих молекул обозначается как АdE2 (бимолекулярная реакция) или АdE3 (тримолекулярная реакция).
следует рассматривать именно как электрофильное присоединение к кратной связи алкена. Известно большое число реакций этого типа, где роль электрофильного агента выполняют галогены, галогеноводороды, вода, соли двухвалентной ртути и другие полярные реагенты. Электрофильное присоединение к двойной связи в классификации механизмов органических реакций имеет символ АdE(Addition Electrophilic) и в зависимости от числа реагирующих молекул обозначается как АdE2 (бимолекулярная реакция) или АdE3 (тримолекулярная реакция).
12. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ.
| 1.Присоединение галогенов |
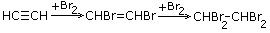
|
| 2.Присоединение водорода |
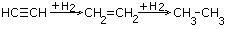
|
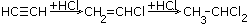
| 3.Присоединение галогенводородов |
|
| 4.Присоединение воды |
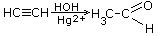
|
| 5.Присоединение спиртов |

|
| 6.Присоединение кислот |
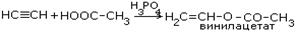
|
| 7.Присоединение синильной кислоты |
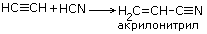
|
| 8.Реакция димеризации |
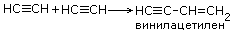
|
13 Гомологический ряд алкинов:
Этин: C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
Номенклатура алкинов
Молучение алкинов
14 ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ)
Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2.
В зависимости от взаимного расположения двойных связей диены подразделяются на три типа:
1) углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен или аллен CH2=C=CH2;
2) углеводороды с изолированными двойными связями, т.е разделенными двумя и более простыми связями. Например, пентадиен -1,4 CH2=CH–CH2–CH=CH2;
3) углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью. Например, бутадиен -1,3 или дивинил CH2=CH–CH=CH2, 2-метилбутадиен -1,3 или изопрен
|
|
|
| CH2=С–CH=CH2. I CH3 |
Наибольший интерес представляют углеводороды с сопряженными двойными связями.
Получение
Углеводороды с сопряженными двойными связями получают:
1) дегидрированием алканов, содержащихся в природном газе и газах нефтепереработки, при пропускании их над нагретым катализатором
CH3–CH2–CH2–CH3 ––~600°С;Cr2O3,Al2O3® CH2=CH–CH=CH2 + 2H2
| CH3– | CH–CH2–CH3 ––~600°С;Cr2O3,Al2O3® CH2= I CH3 | C–CH=CH2 + 2H2 I CH3 |
2) дегидрированием и дегидратацией этилового спирта при пропускании паров спирта над нагретыми катализаторами (метод акад. С.В.Лебедева)
2CH3CH2OH ––~450°С;ZnO,Al2O3® CH2=CH–CH=CH2 + 2H2O + H2
Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется в эфире, бензоле, не растворяется в воде.
2- Метилбутадиен -1,3 – летучая жидкость, t°пл.= -146°C, t°кип.= 34,1°C; растворяется в большинстве углеводородных растворителях, эфире, спирте, не растворяется в воде.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 546; Нарушение авторских прав?; Мы поможем в написании вашей работы!