
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции замещения – галогенирование
|
|
|
|
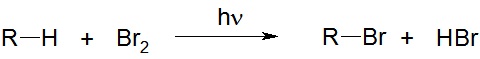
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Реакция алканов с хлором и бромом идет на свету или при нагревании.
3.Системы с замкнутой цепью сопряжения.
В замкнутых сопряженных системах создаются условия для круговой делокализации р-электронов, и они обладают особыми ароматическими свойствами.
    
| ||||
| бензол | нафталин | тиофен | пиррол | пиридин |

Под ароматичностью понимается способность плоскостных циклических систем с замкнутой системой сопряжения, охватывающей все атомы цикла, вступать в обычных условиях в реакции замещения, а не присоединения и обладать повышенной устойчивостью цикла к разрыву и окислению. Типичной карбоциклической ароматической системой является молекула бензола. Все атомы углерода в молекуле находятся в sр2-гибридизованном состоянии, -скелет молекулы плоскостной, р-орбитали располагаются перпендикулярно -скелету и параллельно друг другу. В результате образуется единая 6-центровая ---сопряженная система. Ее образование приводит к выравниваю всех расстояний между углеродными атомами до 0,140 нм и стабилизации молекулы. Энергия сопряжения составляет для бензола 150,5 кДж/моль. Бензол термодинамически устойчив; он выдерживает нагревание до 900 С. Наличие замкнутого электронного кольца доказывается с помощью ядерно-магнитного резонанса.
Ароматическими свойствами обладает не только бензол и его гомологи, но и соединения с конденсированными бензольными ядрами (нафталин, антрацен), некоторые ионы (циклопентадиенильный анион, циклогептатриенильный катион), гетероциклические соединения, если они удовлетворяют критериям ароматичности.
|
|
|
Критерии ароматичности были установлены Хюккелем в 1931 году и получили название правило Хюккеля. Система ароматична, если она обладает совокупностью следующих признаков:
а) все атомы в цикле находятся в sр2-гибридизации (следовательно -скелет плоскостной);
б) молекула имеет циклическую систему сопряжения;
в)в сопряжении участвует (4n+2) р-электрона, где n — целое число (n=0,1,2,3,4...).
Бензол отвечает правилу Хюккеля при n=1, т.е. в сопряжении участвует 6 р-электронов.
Ароматические свойства характерны и для конденсированных систем. Конденсированными называются системы, у которых два и более циклов имеют общие пары углеродных атомов.
  
| ||
| нафталин 10 р-электронов (n = 2) | антрацен 14 р-электронов (n = 3) | фенантрен 14 р-электронов (n = 3) |
В этих системах все атомы углерода находятся в sр2-гибридизации, следовательно, -скелет плоскостной, и р-орбитали располагаются параллельно. Сопряжение замкнутое и в сопряжении участвуют соответственно 10 и 14 р-электронов. Следовательно, эти системы, подобно бензолу, проявляют ароматические свойства.
Ароматическими свойствами могут обладать не только молекулы, но и ионы, например, циклопентадиенильный анион. Циклопентадиен не является ароматической системой, так как не выполняются критерии ароматичности: система не плоскостная, так как один из атомов углерода находится в sр3-гибридизованном состоянии; имеющееся --сопряжение не является замкнутым, и в сопряжении участвует 4 р-электрона (n=1/2). Однако, если данное вещество обрабатывать гидридом натрия в среде кипящего ксилола, то образуется устойчивое соединение с ароматическими свойствами — циклопентадиенильный анион:

В этих условиях происходит отщепление Н+ от sр3-гибридизованного атома углерода, и он переходит в sр2-гибридизованное состояние. Система приобретает отрицательный заряд и становится плоской. В сопряжении наряду с электронами -связей будут принимать участие и 2-р-электрона пятого атома углерода (-р-сопряжение). Сопряжение становится циклическим, а система ароматической, так как в сопряжении будут участвовать 6 р-электронов (n=1).
|
|
|
4. Реакции электрофильного присоединения к алкадиенам.
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле СnН2n-2.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
• алкадиены с кумулированным расположением двойных связей
СН2=С=СН2
• алкадиены с сопряженными двойными связями
CH2=CH—CH=CH2
• алкадиены с изолированными двойными связями
CH2=CH—CH2—CH=CH2
Эти три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии ер-гибридизации. Он образует две Þ-связи, лежащие на одной прямой и направленные в противоположные стороны, и две я-связи, лежащие в перпендикулярных плоскостях. п -Связи образуются за счет негибридизованных р-орбиталей каждого атома углерода.
Свойства алкадиенов с изолированными двойными связями практически ничем не отличаются от свойств алкенов, разве что алкадиены вступают в соответствующие реакции в две ступени. Атомы углерода, образующие двойные связи, находятся в sр2-гибридизации.
Свойства алкадиенов с сопряженными связями весьма специфичны, так как сопряженные л-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные п -связи, фактически составляют единую систему (ее называют п -системой), так как р-орбитали соседних л-связей частично перекрываются.
Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными двойными связями является способность присоединять молекулы как в положения 1 и 2 (1,2-присоединение), так и в положения 1 и 4 (1,4-присоединение):
Вr Вr
| |
СН2=СН—СН=СН2 + Вг2 —> CH2—CH—CH=CH2
1,2-присоединение
|
|
|
Вг Вг
| l
CH2=CH—СН=СН2 + Вг2 —> CH2—CH=CH—CH2
1,4-присоединение
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
5.π, π- сопряжение в органических молекулах.
π,π -Сопряжение. Простейшим представителем π,π-сопряженных систем с углеродной цепью служит бутадиен-1,3 (рис. 2.6, а). Атомы углерода и водорода и, следовательно, все σ-связи в его молекуле лежат в одной плоскости, образуя плоский σ-скелет. Атомы углерода находятся в состоянии sр2-гибридизации. Негибридизованные р-АО каждого атома углерода расположены перпендикулярно плоскости σ-скелета и параллельно друг другу, что является необходимым условием для их перекрывания. Перекрывание происходит не только между р-АО атомов С-1 и С-2, С-3 и С-4, но и между р-АО атомов С-2 и С-3, в результате чего образуется охватывающая четыре атома углерода единая π-система, т. е. возникает делокализованная ковалентная связь (см. рис. 2.6, б).
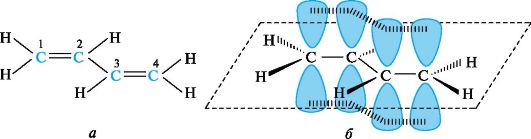
Рис. 2.6. Атомно-орбитальная модель молекулы бутадиена-1,3
Это отражается в изменении длин связей в молекуле. Длина связи С-1-С-2, а также С-3-С-4 в бутадиене-1,3 несколько увеличена, а расстояние между С-2 и С-3 укорочено по сравнению с обычными двойными и одинарными связями. Другими словами, процесс делокализации электронов приводит к выравниванию длин связей.
Углеводороды с большим числом сопряженных двойных связей распространены в растительном мире. К ним относятся, например, каротины, обусловливающие окраску моркови, томатов и т. п.
Открытая система сопряжения может включать и гетероатомы. Примером открытых π,π-сопряженных систем с гетероатомом в цепи могут служить α,β-ненасыщенные карбонильные соединения. Например, альдегидная группа в акролеине CH2=CH-CH=O явля- ется участником цепи сопряжения трех sр2-гибридизованных атомов углерода и атома кислорода. Каждый из этих атомов вносит в единую π-систему по одному р-электрону.

Формально атом С-3 в аллил-катионе несет положительный заряд, в аллильном радикале - неспаренный электрон, а в аллил-анионе - отрицательный заряд. В действительности в таких сопряженных системах имеется делокализация (рассредоточение) электронной плотности, что приводит к выравниванию связей и зарядов. Атомы С-1 и С-3 в этих системах равноценны. Например, в аллил-катионе каждый из них несет положительный заряд +1/2 и связан «полуторной» связью с атомом С-2.
|
|
|
Таким образом, сопряжение приводит к существенному различию в распределении электронной плотности в реальных структурах по сравнению со структурами, изображаемыми обычными формулами строения.
6. Реакции электрофильного замещения в органических молекулах.
Реакции электрофильного замещения
Реакции электрофильного замещения (англ. substitution electrophilic reaction) — реакции замещения, в которых атаку осуществляет электрофил — частица, заряженная положительно или имеющая дефицит электронов. При образовании новой связи уходящая частица — электрофуг отщепляется без своей электронной пары. Самой популярной уходящей группой является протон H+.
Все электрофилы являются кислотами Льюиса.
Выделяют реакции ароматического (широко распространены) и алифатического (мало распространены) электрофильного замещения. Характерность реакций электрофильного замещения именно для ароматических систем объясняется высокой электронной плотностью ароматического кольца, способного притягивать положительно заряженные частицы.
Реакции ароматического электрофильного замещения играют крайне важную роль в органическом синтезе и широко используются как в лабораторной практике, так и промышленности.
Большинство реакций ароматического электрофильного замещения протекает по единому механизму:
Реакция начинается с образования p -комплекса, в котором p -электронная система ароматического ядра выступает как донор электронов, а электрофильный реагент (Е+) действует как акцептор. Далее p -комплекс с нарушением ароматической системы медленно перегруппировывается в s -комплекс, в котором электрофил связан s -связью с определенным атомом углерода, а положительный заряд делокализован по сопряженной системе бывшего ароматического кольца. Делокализация положительного заряда в s -комплексе происходит в основном за счет о- и п-положений по отношению к вступающему заместителю, что может быть показано с помощью набора резонансных структур
На последней стадии происходит отщепление протона от s -комплекса под действием основания с восстановлением ароматической системы. Лимитирующей стадией в процессе электрофильного замещения является стадия образования s -комплекса.
Ход реакции и ее механизм иллюстрирует энергетическая диаграмма, представленная на рисунке:
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1081; Нарушение авторских прав?; Мы поможем в написании вашей работы!