
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ориентация и реакционная способность 2 страница
|
|
|
|
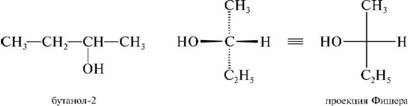
сн3 сн2 сн2 сн3
14.Реакции электрофильного присоединения к алкинам.
Алкины. Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов СnН2n-2.
По номенклатуре ИЮПАК наличие тройной связи в молекуле обозначается суффиксом -ин, который заменяет суффикс -ан в названии соответствующего алкана.
Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
Физические свойства. По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины C2—C4представляют собой газы, С5—C16 — жидкости, высшие алкины — твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
Способы получения. 1. Общим способом получения алкинов является реакция дегидрогалогенирования -отщепления двух молекул галогеноводорода от дигалогензамещенных алканов, которые содержат два атома галогена либо у соседних атомов углерода (например, 1,2-дибромпропан), либо у одного атома углерода (2,2-дибромпропан). Реакция происходит под действием спиртового раствора гидроксида калия:
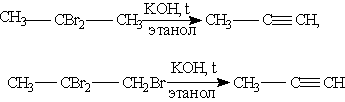
2. Важнейший из алкинов — ацетилен — получают в промышленности путем высокотемпературного крекинга метана:

В лаборатории ацетилен можно получить гидролизом карбида кальция:
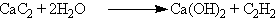
Химические свойства. Тройная связь образуется двумя атомами углерода в sp-гибридном состоянии. Две s -связи расположены под углом 180°, а две p -связи расположены во взаимно перпендикулярных областях. Наличие p -связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p -электронная плотность тройной связи расположена более комплексно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
|
|
|
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
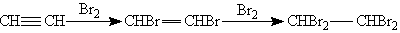
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера — поливинилхлорида;
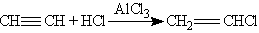
3. Гидратация. Присоединение воды к алкинам катализируется солями ртути(П) (реакция Кучерова):
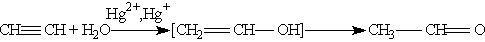
На первой стадии реакции образуется непредельный спирт, в котором гидроксогруппа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой большинства енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом p -связь между атомами углерода разрывается и образуется p -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связиС == О по сравнению с двойной связью С == С.
В результате реакции гидратации только ацетилен превращается в альдегид, гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, пропин превращается в ацетон:
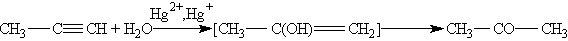
4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т, е, проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s -связи º С Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами.
|
|
|
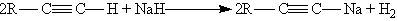
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:
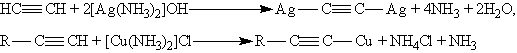
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:
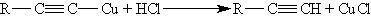
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, давая винилацетилен:
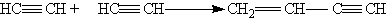
Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
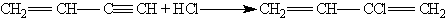
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
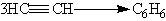
6. Реакции окисления и восстановления. Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:
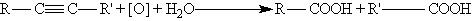
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
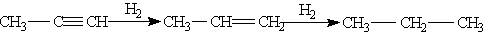
Применение. Ацетилен применяется в качестве исходного сырья для многих промышленных химических синтезов. Из него получают уксусную кислоту, синтетический каучук, поливинилхлоридные смолы. Тетрахлорэтан СНСl2—CHCl2 — продукт присоединения хлора к этилену — служит хорошим растворителем жиров и многих органических веществ и, что очень важно, безопасен в пожарном отношении. Ацетилен используют для автогенной сварки металлов
|
|
|
15.Пространственное строение и стереоизомерия органических соединений.
| ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ (СТЕРЕОХИМИЯ) Так уж повелось, что реальные трехмерные молекулы химик привык изображать с помощью структурных формул на плоском листе бумаги, как это предписывает теория химического строения. По этой причине наша химическая мысль развивается, прежде всего, в двумерном пространстве. До поры до времени это не вредит делу, потому что многие макроскопические проявления химической индивидуальности того или иного вещества (цвет, физическое состояние или даже реакционную способность) можно охарактеризовать только скалярными (не имеющими выраженного направления) параметрами его внутреннего строения. Однако остаются еще и векторные (стереонаправленные) корреляции между химическими свойствами и признаками молекулярных систем. Мы рискуем просто потерять их, если в своем химическом сознании так и не сумеем выйти за пределы плоского двумерного листа бумаги. Вот почему, совершенно необходимо отдельно обсудить все те специальные научные аспекты современной химии, которые связаны с проникновением химического воображения именно в трехмерное пространство, рассмотреть пространственное строение органических соединений (стереохимию). Стереохимические представления начали утверждаться в органической химии более ста лет тому назад. В настоящее время стереохимические явления (стереоизомерия, конформационный анализ, динамическая стереохимия) изучены основательно и показана их важная роль в решении основной проблемы химии - создании материалов и веществ с заданными свойствами. Основой стереохимических представлений в органической химии является стереохимическая теория Вант-Гоффа-Ле-Беля. 2.1 СТЕРЕОХИМИЧЕСКАЯ ТЕОРИЯ ВАНТ-ГОФФ-ЛЕ-БЕЛЯ Предпосылкой для возникновения стереохимической теории явилось невозможность объяснения свойств некоторых органических соединений с точки зрения плоскостного строения, с точки зрения теории химического строения А.М.Бутлерова. Так, например, теория химического строения предполагала существование только одной молочной кислоты, строение которой изображалась структурной формулой (2.1): На самом же деле существует три молочных кислоты: мясо-молочная кислота с т.пл.25-26OC, []20D = -2,26O, правовращающая молочная кислота с т.пл.25-26OC, []20D = +2,3O и молочная кислота брожения с т.пл.18OC, []20D = 0O. Также невозможно было объяснить различие между фумаровой (т.пл.287 OC, растворимость в воде 1:150, встречается в природе, не ядовита, образует ангидрид) и малеиновой (т.пл.130 OC, растворимость в воде 1:2, не встречается в природе, ядовита, образует ангидрид) кислотами, обе имеют одинаковую брутто-формулу и обе являются двухосновными. В 1874 г. Якоб Генрих Вант-Гофф опубликовал работу под заголовком «Химия в пространстве», в которой, созданное Бутлеровым представление о химическом строении дополнил представлением о пространственном расположении атомов в молекуле. В соответствии с теорией Вант-Гоффа углеродный атом не является плоским. Четыре валентности углеродного атома направлены к четырем углам тетраэдра, в центре которого находится углеродный атом (2.2). Из этого неизбежен вывод, что когда у углеродного атома все четыре заместителя различны, возникают две формы (оптические антиподы), которые нельзя совместить в пространстве (2.3). Рассматривая структурные формулы веществ, способных существовать в виде двух оптических антиподов (молочная кислота), Вант-Гофф установил, что они содержат атом углерода, связанный с четырьмя различными заместителями. Таким образом, возникла мысль, что две пространственные геометрические модели отвечают двум реально существующим объектам - оптическим антиподам. Атом углерода, связанный с четырьмя различными заместителями Вант-Гофф назвал асимметрическим атомом. Следовательно, причиной оптической активности является наличие асимметрического атома, вызывающего появление двух пространственных форм молекулы, двух оптических антиподов. Оптические антиподы отличаются друг от друг, прежде всего отношением к поляризованному свету. Если один антипод способен вращать плоскость поляризации света на некий угол в одну сторону (например, влево), то второй антипод будет вращать плоскость поляризации на тот же самый угол в противоположную сторону (например, вправо). Оба тетраэдра относятся друг к другу как предмет к своему изображению в зеркале; поэтому оптическую изомерию называют также зеркальной изомерией. Для обозначения пары оптических антиподов пользуются часто названием «энантиомерные (или энантиоморфные) формы», «энантиомеры». Таким образом, с помощью предложенной Вант-Гоффом (а ныне физически доказанной) тетраэдрической модели углеродного атома можно объяснить появление двух оптических антиподов веществ, в молекуле которых имеется асимметрический атом углерода. Однако этим далеко не исчерпываются все возможности тетраэдрической модели. Продолжая рассуждения, Вант-Гофф переходит от соединений, в молекулы которых входит один атом углерода, к соединениям более сложным, молекулы которых содержат два и более углеродных атомов. Известно, что соединения типа С2Х6 (простейший случай— этан) стереоизомеров не имеют. Между тем, если построить соответствующую тетраэдрическую модель (два тетраэдра, соприкасающиеся одной из вершин), то можно предвидеть бесконечное множество взаимных поворотов пары тетраэдров по простой С-С-связи. Например, молекулу этана можно изобразить в двух вариантах (2.5 и 2.6) при рассмотрении модели молекулы (2.4) «сверху» вдоль оси, соединяющей углеродные атомы. Отсутствие подобных изомеров заставляет предположить, что либо всегда по каким-то причинам (например, энергетическим) реализуется только одно из возможных геометрических положений, либо существует свободное вращение. Так, сочетая тетраэдрическую модель с методом «соответствия числа изомеров», Вант-Гофф вывел «правило свободного вращения вокруг простой связи». В настоящее время считают, что «изомеры» типа изображенных выше (2.4-2.6) в ряде случаев существуют. Однако они столь легко переходят друг в друга, что разделить их обычно не удается. Такие изомеры называют поворотными изомерами. Говорят также, что молекула в этих случаях обладает различной конформацией. Молекулу вещества, содержащего два углеродных атома, соединенных двойной связью, можно представить в виде модели, в которой тетраэдры соприкасаются двумя вершинами (2.7): Эта модель наглядно показывает, что свободного вращения по двойной связи в этих соединениях быть не может (для этого в момент поворота: должен был бы происходить разрыв связи). Но в таком случае при наличии двух разных заместителей у каждого из ненасыщенных атомов должны возникать две геометрические формы— цис- и транс-. Этому отвечает существование геометрических изомеров (фумаровой и малеиновой кислот). Молекулы с тройной связью изображаются моделью, в которой тетраэдры соприкасаются тремя вершинами, т. е. одной из граней (2.8): Это значит, что в молекуле X—С=С—X все четыре атома должны располагаться на одной прямой. Отсюда следуют отвечающие экспериментальным фактам выводы, что у молекул рассматриваемого типа не может быть и действительно не существует геометрических изомеров. Пользуясь тетраэдрической моделью, Вант-Гофф высказал предположение, что оптическая изомерия может проявляться у веществ, молекулы которых не содержат асимметрического атома. В частности, Вант-Гофф предсказал, что у соединений алленового типа (2.9) должны существовать оптические антиподы: Во времена Вант-Гоффа соединения такого типа были неизвестны, но когда в 30-х годах XX столетия подобные соединения были получены, предсказание Вант-Гоффа оправдалось. Алленовые соединения представляют один из примеров молекулярной асимметрии, которая возникает не вследствие наличия асимметрического атома углерода, а из-за асимметрии молекулы в целом. Чтобы покончить с рассмотрением истории возникновения основ стереохимии, следует сказать несколько слов о французском ученом Ле-Беле, имя которого упоминается обычно наряду с именем Вант-Гоффа в связи с созданием стереохимической гипотезы. Действительно, двумя месяцами позднее Вант-Гоффа и независимо от него Ле-Бель опубликовал работу, в которой объяснял появление оптической активности пространственными особенностями строения молекул примерно так же, как это сделал и Вант-Гофф. В приложении к объяснению причин оптической активности при наличии так называемого «асимметрического атома» оба подхода давали одинаковый результат, однако более четко сформулированная теория Вант-Гоффа оказалась значительно плодотворнее при объяснении ряда других фактов. В последующие годы гипотеза Вант-Гоффа –Ле-Беля получила экспериментальное подтверждение и превратилась наряду с теорией химического строение в основополагающую теорию органической химии. 16.Строение нуклеотидов. ДНК и РНК. В природе существует два вида нуклеиновых кислот: дезоксирибонуклеиновые, или ДНК, и рибонуклеиновые, или РНК.Название произошло от углевода, входящего в состав нуклеиновых кислот. Молекула ДНК содержит сахар дезоксирибозу, а молекула РНК – рибозу. В настоящее время известны хромосомальная и внехромосомальная ДНК и рибосомальная, информационная и транспортная РНК, которые участвуют в синтезе белка. ДНК включает множество генов, определяющих различия в метаболизме. Например, ДНК бактериальной клетки кишечной палочки содержит несколько тысяч различных генов, а у животных и растений – много больше, причем каждый вид организмов имеет характерный только для него набор генов. Однако многие гены – общие для всех организмов, что подтверждает общность происхождения живых существ. ДНК состоит из двух полинуклеотидных цепей, которые соединяются при водородных связей между азотистыми основаниями по принципу комплементарности – это принцип строгова соответствия. Цепи соединены антипаралельно,. Цепи ДНК в силу своей неравномерности распределения водородных связей, цепи закручиваются в спираль. Один виток содержит около 10 нуклеотидов. ДНК главным образом содержится в ядре клетки, но она так же входит в состав пластид и митохондрий. В ее структуре содержится вся генетическая информация. ДНК участвует в ее хранении и реализации. Колличкство ДНК в самотических клетках постоянна в пределах одного вида. ДНК обладает важным свойством репликацией. Репликация ДНК происходит в S период клеточного цикла в интерфазе, при подготовке клетки к делению. Под действием фермента ДНК-полимиразы, молекула ДНК раскручивается и водородные связи разрывыаются. Затем цпи расходятся и служат матрицами для синтеза длчерних цепей. При этом направление синтеза определяется С3 положением. Поэтому на одной зи цепей синтез происходит непрерывно – лидирующая цепь, а на другой цепи синтез происходит в виде фрагментов, которые потом сшиваются – отстающая цепь. Полинуклеотидная цепь ДНК состоит из нуклеотидов. А что является структурными компонентами нуклеотидов? В состав любого нуклеотида ДНК входит одно из четырех азотистых оснований: аденин (А), гуанин (Г), тимин (Т) и цитозин (Ц), а также сахар дезоксирибоза (C3H10O4) и остаток фосфорной кислоты. Они отличаются только азотистыми основаниями, которые попарно имеют близкое химическое строение: Ц подобен Т (они относятся к пиримидиновым основаниям), А подобен Г (они относятся к пуриновым основаниям). А и Г по размерам несколько больше, чем Т и Ц. В ДНК входят нуклеотиды только четырех видов. Между азотистыми основаниями нуклеотидов разных цепей образуются водородные связи (между А и Т – две, а между Г и Ц – три). При этом А соединяется водородными связями только с Т, а Г – с Ц. В результате у всякого организма число адениловых нуклеотидов равно числу тимидиловых, а число гуаниловых – числу цитидиловых. Эта закономерность получила название правила Чаргаффа. Благодаря этому свойству последовательность нуклеотидов в одной цепочке определяет их последовательность в другой, т.е. цепи ДНК являются как бы зеркальными отражениями друг друга. Такое избирательное соединение нуклеотидов называется комплементарностью, и это свойство лежит в основе самосборки новой полинуклеотидной цепи ДНК на базе исходной. Помимо водородных связей в стабилизации структуры двойной спирали участвуют и гидрофобные взаимодействия. |
РНК — полимер, мономерами которой являются рибонуклеотиды. В отличие от ДНК, РНК образована не двумя, а одной полинуклеотидной цепочкой (исключение — некоторые РНК-содержащие вирусы имеют двухцепочечную РНК). Нуклеотиды РНК способны образовывать водородные связи между собой. Цепи РНК значительно короче цепей ДНК.
|
|
|
Мономер РНК — нуклеотид (рибонуклеотид) — состоит из остатков трех веществ:
1) азотистого основания,
2) пятиуглеродного моносахарида (пентозы) и
3) фосфорной кислоты. Азотистые основания РНК также относятся к классам пиримидинов и пуринов.
Пиримидиновые основания РНК — урацил, цитозин, пуриновые основания — аденин и гуанин. Моносахарид нуклеотида РНК представлен рибозой.
Выделяют три вида РНК:
1) информационная (матричная) РНК — иРНК (мРНК),
2) транспортная РНК — тРНК,
3) рибосомная РНК — рРНК.
Все виды РНК представляют собой неразветвленные полинуклеотиды, имеют специфическую пространственную конформацию и принимают участие в процессах синтеза белка. Информация о строении всех видов РНК хранится в ДНК. Процесс синт
Транспортные РНК содержат обычно 76 (от 75 до 95) нуклеотидов; молекулярная масса — 25 000–30 000. На долю тРНК приходится около 10% от общего содержания РНК в клетке.
Функции тРНК:
1) транспорт аминокислот к месту синтеза белка, к рибосомам,
2) трансляционный посредник. В клетке встречается около 40 видов тРНК, каждый из них имеет характерную только для него последовательность нуклеотидов. Однако у всех тРНК имеется несколько внутримолекулярных комплементарных участков, из-за которых тРНК приобретают конформацию, напоминающую по форме лист клевера. У любой тРНК есть петля для контакта с рибосомой (1), антикодоновая петля (2), петля для контакта с ферментом (3), акцепторный стебель (4), антикодон (5). Аминокислота присоединяется к 3'-концу акцепторного стебля.
Антикодон — три нуклеотида, «опознающие» кодон иРНК. Следует подчеркнуть, что конкретная тРНК может транспортировать строго определенную аминокислоту, соответствующую ее антикодону. Специфичность соединения аминокислоты и тРНК достигается благодаря свойствам фермента аминоацил-тРНК-синтетаза.
Рибосомные РНК содержат 3000-5000 нуклеотидов; молекулярная масса — 1 000 000-1 500 000. На долю рРНК приходится 80-85% от общего содержания РНК в клетке. В комплексе с рибосомными белками рРНК образует рибосомы — органоиды, осуществляющие синтез белка. В эукариотических клетках синтез рРНК происходит в ядрышках.
Функции рРНК:
1) необходимый структурный компонент рибосом и, таким образом, обеспечение функционирования рибосом;
2) обеспечение взаимодействия рибосомы и тРНК;
3) первоначальное связывание рибосомы и кодона-инициатора иРНК и определение рамки считывания,
4) формирование активного центра рибосомы.
Информационные РНК разнообразны по содержанию нуклеотидов и молекулярной массе (от 50 000 до 4 000 000). На долю иРНК приходится до 5% от общего содержания РНК в клетке.
Функции иРНК:
1) перенос генетической информации от ДНК к рибосомам,
2) матрица для синтеза молекулы белка,
3) определение аминокислотной последовательности первичной структуры белковой молекулы
РНК построена из тех же азотистых оснований, что и ДНК, но вместо тимина в ее состав входит урацил. Кроме того, углевод нуклеотидов РНК представлен рибозой.
Как происходит соединение нуклеотидов между собой в полинуклеотидной цепи?
В полинуклеотидной цепи соседние нуклеотиды связаны между собой ковалентными связями, которые образуются между дезоксирибозой (в молекуле ДНК) или рибозой (в молекуле РНК) одного нуклеотида и остатком фосфорной кислоты другого нуклеотида.
Чем объясняется огромное разнообразие генов в составе молекулы ДНК?
Хотя ДНК содержит всего четыре типа разных нуклеотидов, благодаря различной последовательности их расположения в длинной цепочке достигается огромное разнообразие их сочетаний в молекуле.
17.Ковалентные связи в органических соединениях.
КОВАЛЕНТНАЯ СВЯЗЬ - (от латинского «со» совместно и «vales» имеющий силу) (гомеополярная связь), химическая связь между двумя атомами, возникающая при обобществлении электронов, принадлежавших этим атомам. Ковалентной связью соединены атомы в молекулах простых газов. Связь, при которой имеется одна общая пара электронов, называется одинарной; существуют также двойные и тройные связи.
Рассмотрим несколько примеров, чтобы увидеть, как мы можем использовать наши правила для определения количества ковалентных химических связей, которые может образовать атом, если мы знаем количество электронов на внешней оболочке данного атома и заряд его ядра. Заряд ядра и количество электронов на внешней оболочке определяются экспериментальным путем и включены в таблицу элементов.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 513; Нарушение авторских прав?; Мы поможем в написании вашей работы!