
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение электронной оболочки ароматических систем
|
|
|
|
Тенденция бензола и его производных к сохранению структуры сопряженного кольца в различных превращениях означает повышенную термодинамическую и кинетическую устойчивость этого структурного фрагмента. Стабилизация (понижение электронной энергии) молекулы или иона. обладающих циклической структурой, достигается при полном заполнении электронами всех связывающих молекулярных  орбиталей и вакантности несвязывающих и антисвязывающих орбиталей. Выполнение этих условий достигается, когда общее число
орбиталей и вакантности несвязывающих и антисвязывающих орбиталей. Выполнение этих условий достигается, когда общее число 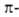 электронов в циклическомполиене равно (4л + 2), где п = = 0,1,2... (правило Хюккеля).
электронов в циклическомполиене равно (4л + 2), где п = = 0,1,2... (правило Хюккеля).
Это правило объясняет устойчивость бензола (ф-ла I) и циклопентадиенильного аниона (II; п = 1). Оно позволило правильно предсказать устойчивость циклопропенильного (III; п = 0) и циклогептатриенильного (IV; п = 1) катионов. Ввиду подобия  электронных оболочек соединений II-IV и бензола они, как и высшие циклические полиены - [10], [14], [18]аннулены (V-VII), рассматриваются как ароматические системы.
электронных оболочек соединений II-IV и бензола они, как и высшие циклические полиены - [10], [14], [18]аннулены (V-VII), рассматриваются как ароматические системы.
Понятие ароматичности успешно привлекается для описания энергетических характеристик переходных состояний термических перициклических реакций. Такие реакции осуществляются через переходные состояния, которые в зависимости от конформации цикла содержат 4n+2 (хюккелевские системы) или 4n (мебиусовские системы)  электронов.
электронов.
Арены-это и есть ароматические соединения.
Ароматические соединения, характеризуются наличием ароматической системы связей (см. Ароматичность). В более узком смысле к ароматическим соединениям относят только бензоидные соединения, т.е. бензол. би-, три- и полициклические соединения, построенные из конденсированных или неконденсированных бензол.ных ядер, и их производные (ароматические углеводороды наз. аренами).
|
|
|
В конденсированных ароматических соединениях два соседних "срощенных" цикла имеют два общих атома. При этом возможны три типа сочленения циклов: линеарное, или линейное, как в антрацене (ф-ла I) и тетрацене (II); ангулярное, или угловое, например в фенантрен., хризене (III), пицене (IV); пери-сочленение, отличающееся наличием атомов С, общих для трех циклов, как в пирене (V) и коронене (VI). В случае пери-сочленения общее число  электронов не отвечает правилу Хюккеля (4л + 2) и, следовательно, соответствующие соед. не должны относиться к ароматическим. Однако в них можно выделить отдельные составляющие их моноциклические ароматические соединения (обычно с шестью
электронов не отвечает правилу Хюккеля (4л + 2) и, следовательно, соответствующие соед. не должны относиться к ароматическим. Однако в них можно выделить отдельные составляющие их моноциклические ароматические соединения (обычно с шестью  электронами) или рассматривать
электронами) или рассматривать  электронные оболочки по периметру полициклической системы; если они включают 10, 14, 18 и т.д.
электронные оболочки по периметру полициклической системы; если они включают 10, 14, 18 и т.д.  электронов, то в соответствии с правилом Хюккеля их относят к ароматическим. Таким же образом можно рассматривать конденсированные ароматические соединения, включающие не только шестичленные циклы, например инден (VII), флуорен (VIII),аценафтилен (IX):
электронов, то в соответствии с правилом Хюккеля их относят к ароматическим. Таким же образом можно рассматривать конденсированные ароматические соединения, включающие не только шестичленные циклы, например инден (VII), флуорен (VIII),аценафтилен (IX):

Кроме первых членов ряда, например бензол., нафталина. антрацена, к ароматическим соединениям относятся также их замещенные (гомологи, галогензамешенные, нитросоединения, амины, фенолы. карбонильные соединения и др.). Одним из важных типов ароматические соединения являются жирноароматические соединения - гомологи ароматических соединений и их производные с заместителями в алкильных группах, например бензилхлорид С6Н5СН2Сl, фенилуксусная кислота С6Н5СН2СООН.
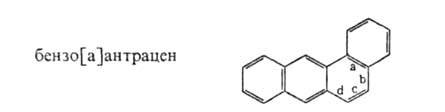
По номенклатуре ИЮПАК и в соответствии с традицией моноциклические ароматические соединения рассматривают как производные бензол.: С6Н5С2Н5-этилбензол, С6Н5Сl - хлорбензол. С6Н5СООН - бензойная кислота, С6Н58О2Сl – бензолcульфохлорид и т.д.; для некоторых сохранены тривиальные назв.: толуол, ксилол, мезитилен, кумол, цимол,стирол, анилин, фенол, крезол. Названия неконденсированных полициклических ароматические соединения строятся по заместительному или соединительному типу, например С6Н5СН2С6Н5 - дифенилметан. С6Н5С6Н5 - бифенил, C6H5C6H4C6H5 - тepенил. Многие конденсир. ароматические соединения имеют тривиальные назв., например нафталин, антрацен, фенантрен. названия более сложных систем основаны на этих тривиальных назв. с добавлением соответствующей приставки и индекса (в квадратных скобках), указывающего место конденсации. например:
|
|
|
Ароматические соединения - жидкости или твердые вещества, отличающиеся от своих алифатических и алициклических аналогов более высокими показателями преломления и поглощением в близкой УФ- или видимой области спектра. Для них характерно наличие т. наз. Магнитного кольцевого тока и поглощение в слабопольной ("ароматической") части спектра ЯМР (область 6,5-8,0 м. д. для 1Н и 110-170 м.д. для 13С).
21.π, π- сопряжение в гетероциклических соединениях.
22.Окисление и восстановление органических соединений.
Окислительно-восстановительные процессы издавна интересовали химиков и даже алхимиков. Среди химических реакций, происходящих в природе, быту и технике, огромное множество составляют окислительно-восстановительные: сгорание топлива, окисление питательных веществ, тканевое дыхание, фотосинтез, порча пищевых продуктов и т.д. В таких реакциях могут участвовать как неорганические вещества, так и органические. Однако если в школьном курсе неорганической химии разделы, посвященные окислительно-восстановительным реакциям, занимают значительное место, то в курсе органической химии на этот вопрос обращено недостаточно внимания.
Что же представляют собой восстановительно-окислительные процессы?
Все химические реакции можно разделить на два типа. К первому относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
Ко второму типу относятся все реакции, идущие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
|
|
|
С современной точки зрения изменение степени окисления связано с оттягиванием или перемещением электронов. Поэтому наряду с приведенным можно дать и такое определение восстановительно-окислительных реакций: это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Рассмотрим основные положения, относящиеся к теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электроном атомом, молекулой или ионом электронов, степени окисления при этом повышаются.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом, степень окисления при этом понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
4. Окисление всегда сопровождается восстановлением; восстановление всегда связано с окислением, что можно выразить уравнениями.
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединения электронов.
Окислительно-восстановительные реакции органических веществ – важнейшее свойство, объединяющее эти вещества. Склонность органических соединений к окислению связывают с наличием кратных связей, функциональных групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Применение понятия «степени окисления» (СО) в органической химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных реакций. Однако, учитывая, что более или менее постоянной состав продуктов реакции возможен только при полном окислении (горении) органических веществ, целесообразность расстановки коэффициентов в реакциях неполного окисления отпадает. По этой причине обычно ограничиваются составлением схемы превращений органических соединений.
|
|
|
Нам представляется важным указывать значение СО атома углерода при изучении всей совокупности свойств органических соединений. Систематизация сведений об окислителях, установление связи между строением органических веществ и их СО помогут научить учащихся [1, 2]:
- Выбирать лабораторные и промышленные окислители;
Находить зависимость окислительно-восстановительной способности органического вещества от его строения;
- Устанавливать связь между классом органических веществ и окислителем нужной силы, агрегатного состояния и механизма действия;
- Предсказывать условия проведения реакции и ожидаемые продукты окисления.
Генетическая связь между классами органических соединений представляется здесь как ряд окислительно–восстановительных реакций, обеспечивающих переход от одного класса органических соединений к другому. Завершают его продукты полного окисления (горения) любого из представителей классов органических соединений.
Изменение СО у атомов углерода в молекуле углерода в молекулах органических соединений приведены в таблице. Из данных таблицы видно, что при переходе от одного класса органических соединений к другому и увеличения степени разветвленности углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется. Органические вещества, в молекулах которых содержатся атомы углерода с максимальными (- и +) значениями СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых к воздействию мягких окислителей и окислителей средней силы. Вещества, в молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко, восстановительные способности их близки, поэту их неполное окисление может быть достигнуто за счет одного из известных окислителей малой и средней силы. Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя, подобно тому, как это присуще неорганическим веществам.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 561; Нарушение авторских прав?; Мы поможем в написании вашей работы!