
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисление и восстановление органических веществ
|
|
|
|
Повышенная склонность органических соединений к окислению обусловлена наличием в молекуле веществ [1, 2]:
- кратных связей (именно поэтому так легко окисляются алкены, алканы, алкадиены);
- определенных функциональных групп – сульфидной -SH, гидроксильной –OH (фенольной и спиртовой), аминной - NH
 ;
; - активированных алкильных групп, расположенных по соседству с кратными связям, например пропен может быть окислен до непредельного альдегида акролеина (кислородом воздуха в присутствии водяных паров на висмут- молибденовых катализаторах):
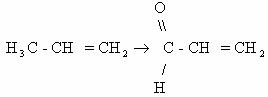
- атомов водорода при атоме углерода, содержащем функциональную группу.
Сравним первичные, вторичные и третичные спирты по реакционной способности к окислению:

Первичные и вторичные спирты, имеющие атомы водорода при атоме углерода, несущем функциональную группу; окисляются легко: первые – до альдегидов, вторые до кетонов. При этом структура углеродного скелета исходного спирта сохраняется. Третичные спирты, в молекулах которых нет атома водорода при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В жестких условиях (при действии сильных окислителей и при высоких температурах) они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е. происходит деструкция углеродного скелета.
23. Атомные орбитали. Гибридизация.
Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома[1], задаётся главным n, орбитальным l имагнитным m квантовыми числами.
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемым ядром атома со всеми остальными электронами атома.
|
|
|
Сам Э.Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяли убеждений Э.Шрёдингера — доказательства существования электрона как «отрицательно заряженного облака» не было.Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден согласиться с доводами М.Борна, которому в 1954 году присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называютэлектронной конфигурацией атома.
|
|
|
Гибридизация атомных орбиталей, квантовохимический способ описания перестройки орбиталей атома в молекулепо сравнению со свободным атомом. Являясь формальным математическим приемом, гибридизация атомных орбиталей позволяет отразить нарушение сферической симметрии распределения электронной плотности атома при образовании химической связи.
Сущность гибридизации атомных орбиталей состоит в том, что электрон молекулы вблизи выделенногибридная орбиталь атомногибридная орбиталь ядра характеризуется не отдельной атомной орбиталью, а линейной комбинацией атомных орбиталей с различным значениями азимутальногибридная орбиталь и магнитногибридная орбиталь квантовых чисел.
Гибридные орбитали обладают более низкой симметрией, чем составляющие их атомные орбитали. Так, распределение электронной плотности, отвечающее указанной гибридной орбитали  , смещено от атомного ядра в направлении вектора п с координатами
, смещено от атомного ядра в направлении вектора п с координатами 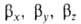 ; вектор п является осью симметрии гибридной орбитали (рис. 1). При изменении ориентации в пространстве осей координат коэффициенты линейной комбинации могут изменяться, однако остается постоянным отношение сумм квадратов коэффициентов для данного значения азимутального квантового числа. Это отношение определяет тип гибридной орбитали. Как правило, гибридные орбитали данного атома в молекуле относятся к одному типу, который называют типом гибридизации атома. Так, атом N в молекуле аммиака имеет гибридизацию атомных орбиталей типа sp3, атом С вмолекуле этилена - sp2-гибридизацию, атом С в молекуле ацетилена - sp-гибридизацию. Это дает основание отождествлять тип гибридизации атома в молекуле с символом его некоей гипотетической электронной конфигурации.
; вектор п является осью симметрии гибридной орбитали (рис. 1). При изменении ориентации в пространстве осей координат коэффициенты линейной комбинации могут изменяться, однако остается постоянным отношение сумм квадратов коэффициентов для данного значения азимутального квантового числа. Это отношение определяет тип гибридной орбитали. Как правило, гибридные орбитали данного атома в молекуле относятся к одному типу, который называют типом гибридизации атома. Так, атом N в молекуле аммиака имеет гибридизацию атомных орбиталей типа sp3, атом С вмолекуле этилена - sp2-гибридизацию, атом С в молекуле ацетилена - sp-гибридизацию. Это дает основание отождествлять тип гибридизации атома в молекуле с символом его некоей гипотетической электронной конфигурации.
Обычно система гибридных орбиталей строится таким образом, чтобы для разных орбиталей одногибридная орбитальатома интегралы перекрывания были равны нулю. Кроме того, каждая орбиталь в молекуле либо остается негибридизированной атомной орбиталью, либо выбирается гибридизированной по определенному типу. Этим требованиям удовлетворяют несколько наборов орбиталей. Например, атом О в молекуле Н2О можно считать как sp2-, так и 5р3-гибридизированным.
|
|
|
Оси симметрии всех орбиталей обычно образуют симметричную фигуру (см. рис. 2). Операции симметрии этой фигуры переводят гибридные орбитали одного атома друг в друга. Такие гибридные орбитали называют эквивалентными. Например, линейная комбинация четырех валентных атомных орбиталей атома С приводит к четырем 5р3-гибридным орбиталям, оси симметрии которых по отношению друг к другу расположены под углом 109,5°, т.е. направлены по углам тетраэдра (рис. 2, в).

Рис. 1. Гибридная орбиталь, образованная из 2s- и 2р-атомных орбиталей; х, у, z- координатные оси, п-ось симметрии.

Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности. Представление о гибридизации атомных орбиталей используется для изучения закономерностей изменения электронной плотности молекулы вблизи какого-либо атомного ядра в зависимости от его окружения, то есть позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны различные подходы к анализу этой связи. Если известно геометрическое расположение атомных ядер, расчет волновой функции молекулы можно свести к изучению парных взаимодействий соседних атомов.
Для такого расчета выбирают одну из возможных систем гибридных орбиталей и располагают ее в пространстве так, чтобы обеспечить макс. перекрывание отдельных пар гибридных орбиталей разных атомов. Другой подход применяется в неэмпирических методах квантовой химии, в которых все взаимодействия атомов в молекулеучитываются одновременно и волновая функция молекулы не зависит от того, атомные или гибридизированные орбитали используются для расчета. В этом случае гибридные орбитали строят после определения волновой функции молекулы таким образом, чтобы в отдельных областях пространства распределение электронной плотности можно было описать одной гибридной орбитали.
|
|
|
В обоих подходах тип гибридизации атомных орбиталей обусловлен геометрической конфигурацией молекулы и для большинства равновесных конфигураций оба подхода приводят к близким формам гибридной орбитали.
В теоретической химии для систематизации экспериментальных данных о равновесных конфигурациях молекул часто применяют феноменологический подход, в рамках которого атомы данного элемента склонны к гибридизации определенного типа, а тип гибридизации определяет взаимное расположение ядер ближайшего окружения.
Отклонение конфигурации молекулы от симметричной связывают с взаимодействием химических связей (напр., с отталкиванием пар электронов, образующих связь). В такой форме представления о гибридизации атомных орбиталей используются в стереохимии.
24.Полипептидная цепь. N- и C-концы.
N- и C-концы всех полипептидных цепей находятся в цитоплазме.
25.Ковалентные связи. Гибридизация.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году[1][2]. Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становилсякатионом, а другой атом принимал электрон и становился анионом.
Позднее (1927 год) Ф.Лондон и В.Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
С учётом статистической интерпретации волновой функции М.Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона.[3]
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождаядипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары»[2]. Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H2+.
Молекулярный ион водорода H2+ содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H2+). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α0=0,53 А и является центром симметрии молекулярного иона водорода H2+.
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
· Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
· Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различныминеметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь. Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
26.Электронние эффекты в органических молекулах.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 688; Нарушение авторских прав?; Мы поможем в написании вашей работы!