
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Развитие современных представлений о строении атома: эксперименты Томсона и Резерфорда. Модель атома Н. Бора. Постулаты Бора. Достоинства и недостатки этой модели
|
|
|
|
Изучая закономерности прохождения  лучей через золотую фольгу, английский ученый Резерфорд в 1911 г. установил: атом представляет собой сложную систему, состоящую из положительно заряженного ядра, в котором и сосредоточена основная масса (99,97%), и движущихся вокруг него отрицательно заряженных частиц – электронов. Это так называемая ядерная или планетарная модель атома. При всех химических превращениях ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменения при этом претерпевают только электронные оболочки. Таким образом, химическая энергия связана только с энергией электронов.
лучей через золотую фольгу, английский ученый Резерфорд в 1911 г. установил: атом представляет собой сложную систему, состоящую из положительно заряженного ядра, в котором и сосредоточена основная масса (99,97%), и движущихся вокруг него отрицательно заряженных частиц – электронов. Это так называемая ядерная или планетарная модель атома. При всех химических превращениях ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменения при этом претерпевают только электронные оболочки. Таким образом, химическая энергия связана только с энергией электронов.
Исходя из теории квантов, датский физик Н. Бор в 1913 г. теоретически обосновал новую модель атома, в основе которой лежали два постулата:
1. Электрон может вращаться вокруг ядра не по любым, а только по строго определённым (стационарным) орбитам, не излучая и не поглощая при этом энергию.
2. Поглощение или излучение энергии происходит только при переходе электрона с одной стационарной орбиты на другую. Смысл этого постулата состоит в том, что при поглощении кванта энергии происходит перескок электрона на более удалённую орбиту, и атом переходит в возбуждённое состояние. Энергия его связи с ядром уменьшается. Если же энергия излучается, то электрон переходит на более близкую к ядру орбиту. Таким образом, второй постулат объясняет дискретность спектров паров и газов.
Теория Бора строго применима только к одному наиболее простому атому – атому водорода, для которого были вычислены не только «дозволенные» орбиты для электрона, но и радиусы этих орбит, орбитальные скорости электрона, потенциальная, кинетическая и полная энергии электрона на этих орбитах. Однако свойства многоэлектронных атомов не объяснялись с позиций этой теории, поэтому требовалось дальнейшее её совершенствование.
|
|
|
3. Квантовые числа: что они характеризуют и какие принимают значения.
1. Главное квантовое число n характеризует:
- число энергетических уровней в атоме;
- энергию электрона на данном энергетическом уровне;
- размер атома.
В общем случае n принимает значения от 1 до. В невозбуждённых атомах, т.е. таких, состояние которых соответствует их расположению в периодической системе элементов Д. И. Менделеева, n изменяется от 1 до 7 в соответствии с числом периодов в периодической системе. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. Например, при n=1 атом водорода находится в основном состоянии, при n 1 – в возбуждённом.
2. Орбитальное или побочное квантовое число l характеризует:
– Энергию электрона на энергетическом подуровне.
На уровне может находиться много электронов (максимально 32), но не все они обладают одинаковой энергией. В результате взаимного отталкивания электронов происходит расщепление энергетического уровня на подуровни (рисунок).
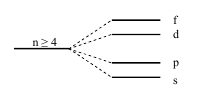
Те электроны, которые принадлежат одному и тому же подуровню, т.е. электроны с одинаковыми значениями l, обладают одинаковой энергией. Такое состояние называют вырожденным по энергии. l принимает значения от 0 до n-1, но это правило справедливо для невозбуждённых атомов для n 4. Кроме числовых значений, l имеет и буквенные обозначения:
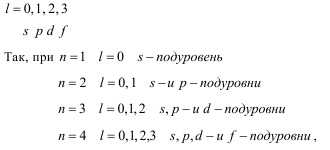 т.е. число энергетических подуровней в пределах данного энергетического уровня;
т.е. число энергетических подуровней в пределах данного энергетического уровня;
- Форму атомных орбиталей.
3. Магнитное квантовое число mi определяет:
- ориентацию атомных орбиталей в пространстве;
- число атомных орбиталей на энергетическом подуровне.
ml принимает целые значения от -l через 0 до +l, т.е. 2 l+1 значений. Например, рассмотрим p-подуровень, для него l=1, ml=-1, 0,+1 – всего 3 значения. Следовательно, число 3 означает, что на данном энергетическом подуровне находится три атомных орбитали, различным образом ориентированных в пространстве.
|
|
|
4. Спиновое квантовое число ms (от английского spin – вращение) упрощено можно представить как описывающее вращение электрона вокруг собственной оси по часовой стрелке и против, поэтому оно имеет только два значения ms= 1/ 2, представляющие собой две проекции углового момента электрона на выделенную ось. Для изображения атомной орбитали и электронов часто используют «квадратики» и «стрелки», направленные вверх или вниз. Два электрона с одинаковыми значениями квантовых чисел n, l, ml, но с противоположно направленными спинами, называются спаренными или неподелённой электронной парой и обозначаются, неспаренные электроны – или. Итак, четыре квантовые числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1209; Нарушение авторских прав?; Мы поможем в написании вашей работы!