
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет 19. Обратимые химические реакции и подвижное химическое равновесие. Константа химического равновесия. Принцип Ле Шателье. Привести примеры
|
|
|
|
Химические реакции делятся на обратимые и необратимые. Если химическая реакция протекает не только между реагирующими веществами, но и междупродуктами реакции, то такие реакции называются обратимыми. В случае обратимых реакций наступает такой момент, когда скорость прямой реакции и обратной становятся одинаковыми. Такое состояние реагирующей системы называется состоянием химического равновесия и дальнейшего измененя конценотраций учавствующих в реакции веществ не происходят. Следовательно, химическое равновесие – это динамическое равновесие, при котором осуществляется непрерывное образованеи и распад реагентов и продуктов реакции. Иными словами особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции.
Константа равновесия – постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции и исходных веществ. Константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния: чем больш константа равновесия, тем больше степень преаращения реагентов в подукты реакции. Переход системы из одного равновесного состояния в другое равновесное состояние называется смещением или сдвигом равновесия.
Направление смещения химического равновесия в результате изменения внешних условий устанавливается принципом подвижного равновесия или принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие сместится в сторону той реакции, которая стремится свести это воздействие к минимуму. Рассмотри влияние различных факторов на данном примере: 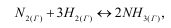
|
|
|
а) влияние изменения концентрации веществ. Если в эту равновесную систему ввести дополнительно некоторое количество водорода или азота, то в системе усиливается процесс, стремящийся понизить концентрацию этих веществ в реакционной смеси. Таким процессом является прямая реакция между N2 и H2, а, следовательно, равновесие сместится в сторону образования аммиака. Вывод: равновесие любой обратимой реакции смещается в сторону продуктов реакции при увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции. Равновесие будет смещаться влево, т. е. в сторону исходных веществ при уменьшении их концентрации или увеличении концентрации продуктов реакции.
б) влияние температуры. Термохимическое уравнение данной реакции показывает, что прямая реакция экзотермическая, так как, а обратная реакция эндотермическая. Следовательно, при увеличении температуры равновесие смещается в сторону эндотермической реакции, т. е. влево, поскольку она противодействует повышению температуры. При уменьшении температуры равновесие смещается в сторону прямой реакции, т. е. вправо, которая препятствует уменьшению температуры. Вывод: при повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
в) в результате увеличения давления повышается концентрация реагирующих веществ и вместе с тем скорость реакции. При уменьшении давления в системе равновесие будет смещаться в сторону обратной реакции. Если в левой и правой частях уравнения находятся одно и то же число моль газов, то при изменении давления равновесие не нарушается. Не влияет давление на равновесие и в том случае, когда все реагирующие вещества находятся в жидком или твердом состоянии.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1994; Нарушение авторских прав?; Мы поможем в написании вашей работы!