
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет 23. Общие свойства растворов неэлектролитов: законы Генри, Рауля и Вант-Гоффа
 |
Билет 22. Способы выражентя растворенного вещества (массовая и мольная доли, молярная и нормальная концентрации, моляльность и титр). Дайте определения. Приведите формулы и размерность величи.
Билет 21. Какие растворы называют насыщенными, ненасыщенными и перенасыщенными? Что такое растворимость и в чем она выражается? Как изменяется растворимость жидкостей, газов и таердых веществ при повышении темпервтуры?
Билет 20.Дайте определение раствора. С чем связано образование раствора? Термодинамическое представление о процессах, протекающих при образовании растворов. Какой раствор назвают идеальным?
Растворы – гомогенные системы переменного состава, состоящие из двух или более веществ, называемых компонентами. По характеру агрегатного состояния растворы могут быть газообразными, твердыми и жидкими. Причиной образования раствороя является взаимодействие молекул растворителя с молекулами растворенного вещества. Об этом свидетельствуют экспериментальные факты: растворение происходит с выделением тепла или с поглащением тепла, изменением давления паров над растворами по сравнению с читсыми растворителями, изменением объёма при образовании растворов.
По термодинамическому признаку растворы делятся на идеальные и реальные. Для идеальных растворов предполагается, что между компонентами раствора отсутствуют любые взаимодействия. Часто растворы приобретают свойства идеальности при достаточно большом разведении это бесконечно разбавленный раствор, когда концентрация растворённого вещества стремится к нулю.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге. Большинство соединений ограниченно растворимы, а многие малорастворимы или практически нерастворимы. Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В насыщеном растворе достигается равновесие между избытком растворяемого вещества (осадком) и раствором. Ненасыщеный характеризуется отсутствием равновесия, если концентрация растворённого вещества меньше его растворимости. Перенасыщеным считается раствор, если в нем содержится вещества больше его растворимости.
|
|
|
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий.
При повышении температуры взаимная растворимость жидкостей увеличивается. Для некоторых комбинаций жидкостей можно достигнуть такой температуры, при которой они растворяются друг в друге в любой пропорции, так что граница между слоями исчезает и вся жидкость становится однородной.
Массовой долей химического элемента ввеществе называется число, показывающее какую часть составляет масса всех атомов данного элемента, содержащихся в одной молекуле вещества, от общей массы молекулы. Массовая доля растворенного вещества равна отношению массы растворенного вещества к массе раствора. 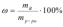
Мольной долей называется число, показывающее, какую часть составляет масса компонента от общей массы смеси, принятой за еденицу. Мольная доля растворенного вещества это отношение колическтва этого вещества к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель. 
Молярная концентрация - отношение количества растворённого вещества к общему объёму раствора. 
Нормальная концентрация - отношению эквивалентного количества вещества к объёму раствора  .
.
|
|
|
Моляльность - отношение количества растворённого вещества к массе растворителя.
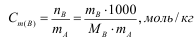
Титр - концентрация стандартного раствора, равная массе вещества содержащегося в 1 мл раствора 
Растворение различных веществ в неводных растворителях, при котором не происходит их диссоциации на ионы, приводит к образованию обширного класса растворов называемых неэлектролитами. Для идеальных растворов, где отсутствуют силы заимодействия между компонентами, любое их свойство при смешении не должно меняться.
Если растворенное вещество характеризуется большой упругостью пара по сравнению с упругостью пара растворителя и при этом оба компонента раствора химически инертны, то растворение такого казообразного веществаа в жидкости подчиняется законц Гени: при постоянной температуте давление летучего компонента прямо пропорционально его мольной доле.
Если упругость пара растворённого вещества очень мала, то его парциальным давлением можно пренебречь, и тогда упругость пара над раствором будет зависеть только от парциального давление растворителя. Первый закон Рауля: парциальное давление над раствором прямо пропорционально мольной доле растворённого вещества. Закон Рауля для нелетучего растворённого компонента: относительное понижение упругости пара над раствором равно мольной доле растворённого вещества. Второй закон Рауля: понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора.
Закон Внт-Гоффа: осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворённое вещество, будучи переведённым в газообразное состояние в том же объёме и при той же температуре. Осмотическое - внутренне давление растворённого вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации. Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1463; Нарушение авторских прав?; Мы поможем в написании вашей работы!