
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водород, его положение в периодической системе химических элементов Д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение
|
|
|
|
Характеризуя водород по положению в периодической системе химических элементов Д. И. Менделеева, следует обратить внимание на особенности строения атома водорода — самого простейшего из химических элементов (состоит из ядра, представляющего собой один протон, и одного электрона). Такое строение обусловливает разнообразие свойств водорода, его двойственное положение в системе Д. И. Менделеева — в I и VII группах (об этом можно рассказать по желанию)*.
Наиболее распространенная степень окисления водорода +1. Водороду свойственна валентность, равная единице.
Молекула водорода двухатомная, связь ковалентная неполярная. Схема образования молекулы водорода:
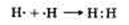
Водород — газ без цвета и запаха, плохо растворим в воде, в 14,5 раз легче воздуха.
л Так же как и у щелочных металлов (Li, Na, К и др.), у Н на внешнем электронном слое один электрон, с другой стороны, так же как и элементам VII группы, водороду не хватает одного электрона до его завершения.
Водород — самый распространенный элемент во Вселенной. На Земле водород содержится в воде, природном газе, нефти.
Получение водорода следует выразить уравнениями химических реакций. Например, в лаборатории водород получают при взаимодействии металлов с растворами кислот, например соляной:

В промышленности водород получают из водяного пара при взаимодействии его с коксом, который в основном состоит из углерода, из природного газа метана СН4 и др.
При характеристике химических свойств водорода необходимо записать уравнения соответствующих реакций.
Водород может быть как восстановителем, так и окислителем:

В этих реакциях водород проявляет свойства восстановителя, его атомы повышают степень окисления до 4-1.
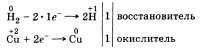
По желанию учащийся может рассказать об окислительных свойствах водорода, которые он проявляет, например, при взаимодействии с металлами:
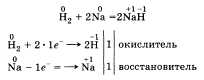
Говоря о применении водорода, стоит рассказать о его использовании в синтезе НСl и NH3, а также резке, сварке и получении металлов, в переработке нефти и жиров.
|
|
|
32. Задача. Какой объем кислорода и воздуха (н. у.) потребуется для сжигания 448 л метана СН4?


|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1038; Нарушение авторских прав?; Мы поможем в написании вашей работы!