
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость гомогеннои химическои реакции. Кинетические кривые.. Порядок реакции. Зависмость скорости от концентрации. Константа скорости
|
|
|
|
Химическое равновесие в гетерогенных системах. Правило фаз Гиббса-Коновалова. Термодинамические понятия: фаза, независимый компонент, число степеней свободы. Константа равновесия гетерогенной химической системы.
Термодинамические функции состояния: энергия Гиббса, энергия Гельмгольца. Критерий самопроизвольного протекания химических процессов в закрытых системах. Методы расчета изменения энергии Гиббса реакции при стандартных условиях.
Реальные процессы проводятся, как правило, в закрытых системах в изобарно-изотермических или изохорно-изотермических условиях. Критерием направленности самопроизвольного процесса в этих случаях является знак изменения энергии Гиббса DG или энергии Гельмгольца DА в системе.
G=H-TS=U+pV-TS, A=U-TS. TS хар-ет связанную с частицами системы энергию, т.е. ту часть полн. Е сист., кот. рассеив. в окр. среде в виде теплоты (потерянная работа). \энергия Гиббса (Гельмг.) – та часть полн. Е системы, кот. м.б. превр. в работу в изоб-изот Илии изох-изот проц. Е G и A – функции состояния системы, их абс. значения не поддаются вычислению. Для выяснения критерия направленности самопр. проц. в закр. сист: dG=dU+dpV+dVp-TdS-dTS, в силу TdS>=dU+pdV => dG<=-SdT+VdP. Для изобарно-изотермического: dG<=0,  . В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изоб.-изот. условиях. При DG=0 система нах. в сост. термод. равн.
. В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изоб.-изот. условиях. При DG=0 система нах. в сост. термод. равн.
Изохорно-изот. проц. в закр. сист. терм-ки возможен при DА<0, невозм, при DА>0, система нах. в термод. равн. при =0.
При const T, p=101,3 кПа:  - Ур-ие Гиббса-Гельмгольца. При равенстве стандартной Е Гиббса нулю в системе устанавливается подвижное ТР, положение которого может смещаться в любую сторону при изменении внешних факторов. DG при 298 К можно рассчитать по стандартным Е Гиббса обр-я исходных веществ и продуктов реакции
- Ур-ие Гиббса-Гельмгольца. При равенстве стандартной Е Гиббса нулю в системе устанавливается подвижное ТР, положение которого может смещаться в любую сторону при изменении внешних факторов. DG при 298 К можно рассчитать по стандартным Е Гиббса обр-я исходных веществ и продуктов реакции  . Стандартной энергией Гиббса образования в-ва называют ст. Е Гиббса р-ции обр-я 1 моль данного соединения из простых в-в, находящихся в термод-ки устойчивых модификациях,кто провед. в станд. термод. услов.
. Стандартной энергией Гиббса образования в-ва называют ст. Е Гиббса р-ции обр-я 1 моль данного соединения из простых в-в, находящихся в термод-ки устойчивых модификациях,кто провед. в станд. термод. услов.
|
|
|
Химический потенциал: для открытой системы G=f(p, T, ni), ni- кол-во в-ва i-го компонента, моль. Масса системы при этом const, но ее состав изменяется. Полный дифференциал:  . Хим. потенциал i-го компонента:
. Хим. потенциал i-го компонента:  . По физ. смыслу: ХП означает изм. G сист. в PT процессе при доб. 1 моль i-го комп. к беск. большому кол-ву смеси, чтобы ее состав был const (nj=const). Для ид. р-ров:
. По физ. смыслу: ХП означает изм. G сист. в PT процессе при доб. 1 моль i-го комп. к беск. большому кол-ву смеси, чтобы ее состав был const (nj=const). Для ид. р-ров:  ,
,  .
.  -стандартный хим. потенциал i-го комп. (при отн-ном давлении
-стандартный хим. потенциал i-го комп. (при отн-ном давлении  ), ХЭ и-ое – мольная доля I компонента. Второе уравнение справедливо для любых ид-х р-ров, первое – для газовых. Для индивид в-ва станд. хим. пот = станд. Е Гиббса обр-я в-ва. При проведении реакции в PT условиях:
), ХЭ и-ое – мольная доля I компонента. Второе уравнение справедливо для любых ид-х р-ров, первое – для газовых. Для индивид в-ва станд. хим. пот = станд. Е Гиббса обр-я в-ва. При проведении реакции в PT условиях:  . Хим. переменная:
. Хим. переменная:  . (глубина, степень протекания реакции, число пробегов).
. (глубина, степень протекания реакции, число пробегов). 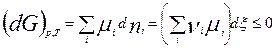 . Получим:
. Получим: 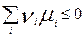 . – общие условия хим. равновесия и самопр. протек. реакции, идущей в закр. системе, при p, T=const.
. – общие условия хим. равновесия и самопр. протек. реакции, идущей в закр. системе, при p, T=const.
Химическое равновесие в гомогенных закрытых системах. Константы равновесия, связь между ними и способы расчета. Уравнения термодинамики: уравнения изотермы, изобары, изохоры химической реакции. Факторы, влияющие на химическое равновесие. Принцип Ле -Шателье,
Под ХИМИЧЕСКИМ РАВНОВЕСИЕМ понимают достигаемое с 2х противоположных сторон и неизменное во времени при постоянных давлении, объеме и температуре состояние системы, сод-ей в-ва, способные к хим. взаимодействию. Различают истинное (достигается только в закрытых системах, хар-ся термод. устойчивостью, подвижностью, обе реакции, прямая и обр-я, в зависимости от условий могут протекать самопроизвольно, динамический характер – непр-е протекание с одинак. скор как прямой, так и обр. р-ции) и замороженное ХР(лишь по 1-му признаку тождественно истинному).
|
|
|
Гомогенные – р-ции, протекающие в одной фазе – газовой или жидкой. Хар-ся отсутствием пов-ти раздела между реаг. и прод. Все уч. нах. в 1 агрег. сост. и сотавл. 1 фазу.
Количественно ХР хар-ют: равновесным составом р-ой смеси; равновесной степенью превр(конверсии) реаг; равновесным выходом продуктов; константой хим. равновесия.
 . Активностью (фугитивностью) называют величину, при посдтановке кот. вместо конц.(парц. давлю) в выр-ия, вывед-е для ид. сист., можно примен. их к идеальным системам. Равновесный выход продукта: например, для в-ва D (1-го из прод.)
. Активностью (фугитивностью) называют величину, при посдтановке кот. вместо конц.(парц. давлю) в выр-ия, вывед-е для ид. сист., можно примен. их к идеальным системам. Равновесный выход продукта: например, для в-ва D (1-го из прод.)  . Для реагентов:
. Для реагентов:  .
.
Константа равновесия – позволяет судить о полноте протекания реакции при тех или иных условиях. Кравн есть величина постоянная для данной хим. р-ции при данных Т, давлении и в данном растворителе = отношению произведения равновесных активностей(или фугитивностей для газов) прод-ов реакции, взятых в степенях = их стехиом. коэф., к анал. произвед. для исх. в-в в состоянии хим. равн. – одна из формулировок закона действующих масс Гульдберга-Вааге для хим. равновесия.
Для гомог. хим. равновесий, устанавливающихся в ид. жидких и газообразных растворах, Кравн можно выразить и через равновесные молярные концентрации и равновесные молярные доли, а для равновесий в газовых смесях – равновесные парциальные давления:
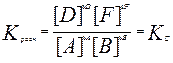 ,
, 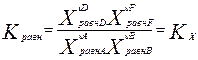 ,
, 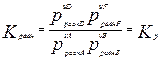
Взаимосвязь между эмпирическими константами:  . Vм-мольный объем смеси. Выводы: если газоф. р. протек. без измен. числа молей газообр. в-в участников, Dn=0, то все константы не зависят от общего (суммарного) давления в системе, безразмерны и равны. Размерность констант зависит от формы записис стехиом. Ур-ия. (и числ. значения так же разнятся). Для газа активность = фугитивности.
. Vм-мольный объем смеси. Выводы: если газоф. р. протек. без измен. числа молей газообр. в-в участников, Dn=0, то все константы не зависят от общего (суммарного) давления в системе, безразмерны и равны. Размерность констант зависит от формы записис стехиом. Ур-ия. (и числ. значения так же разнятся). Для газа активность = фугитивности.
Если Кравн>1, то полож. равновесия смещено вправо (преобл. продукты) и наоборот.
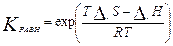 .
.
В любой изолированной системе в состоянии равновесия ее энтропия максимальна и постоянна. Стандартная константа равновесия:  .
.
Связь между константами равновесия и термод. хар-ми сист. устанавливается уравнениями изотермы, изобары и изохоры Х р-ции.
уравнение изотермы в общем виде:  . Оно имеет неск. разновидностей, для р-ций, протек. в ид. р-рах, в него вход. константа равновесия K0C (или Kx) и относительные неравновесные молярные концентрации C(~)i.(или неравн. молярн. доли Xi) компонентов.
. Оно имеет неск. разновидностей, для р-ций, протек. в ид. р-рах, в него вход. константа равновесия K0C (или Kx) и относительные неравновесные молярные концентрации C(~)i.(или неравн. молярн. доли Xi) компонентов.
|
|
|
Стандартное уравнение изотермы хим. р-ции или уравнение стандартного сродства.
Уравнение изобары хим. р. определяет зависимость константы равновесия Kr0 от Т и в диффер. форме выводится на основании стандартного уравнения изотермы и дифф-го уравнения Гиббса-Гельмгольца для станд. условий  , и получаем искомое Ур-ие изобары
, и получаем искомое Ур-ие изобары  , или – внести Т под знак диф-ла (для удобства графического построения). Уравнение изобары в инт. форме – проинтегрировать исходное в узком инт. т-р (где можно считать энтальпию постоянной).
, или – внести Т под знак диф-ла (для удобства графического построения). Уравнение изобары в инт. форме – проинтегрировать исходное в узком инт. т-р (где можно считать энтальпию постоянной).
Если газофазная р-ция осущ-ся в закр. сист при пост. объеме, то: ан-но выводу для изобары (только тут энергия Гельмгольца и внутр. Е и Кс): 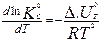 , в интегральной форме (проинтегрировать).
, в интегральной форме (проинтегрировать).
Факторы, влияющие на хим. равновесие:
1. Введение катализатора и изменение концентрации компонентов. Катализатор не влияет на Кравн, поэтому не вызывает его смещения. Ускоряет в равн. степ. как прямую, так и обратную реакцию. Изменение сост-я равн. в рез. изм. внешн. условий наз. смещением или сдвигом положения равновесия. Чаще всего прих. сталкиваться с смещ. пол.равн. в следствие а)изменение конц. или парц. давлений 1 или сразу неск. в-в, участников р-ции, б)изменения Т системы, в) изменения общего давления в системе, г) за счет введения в газообр. равновесн. сист. инертного газа, т.е. разбавления ее.
Принцип Ле Шателье-Брауна: если на систему, находящуюся в состоянии истинного хим. равновесия, оказывать внешнее воздействие путем изменения какого-либо из условий (Ci, T, pi, pобщ), определяющих положение равновесия, то в сист. происх. изменение равновесного состава и смещение положения равновесия в направлении того процесса, протекание которого ослабляет эффект (влияние) этого воздействия.

Если все компоненты находятся в разных фазах, то равновесии называется гетерогенным.

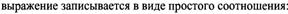
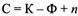




Для гетерогенных систем константы равновесия такие же, как и для гомогенных, только указываются параметры веществ, находящихся в жидком или газовом сост.
|
|
|
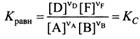

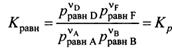
Константа равновесия – позволяет судить о полноте протекания реакции при тех или иных условиях. Кравн есть величина постоянная для данной хим. р-ции при данных Т, давлении и в данном растворителе = отношению произведения равновесных активностей(или фугитивностей для газов) прод-ов реакции, взятых в степенях = их стехиом. коэф., к анал. произвед. для исх. в-в в состоянии хим. равн. – одна из формулировок закона действующих масс Гульдберга-Вааге для хим. равновесия.
Гомогенные реакции – реакции, протекающие в одной фазе. Скорость реакции – скорость возрастания степени завершенности реакции x, которую называют хим. переменной.  , ni- число молей, в мом. времени t, ni0-в начале., ni-стехиом. коэф. (для исх. в-в берется с -, прод с +). Скорость гомогенной хим. реакции – скорость изменения глубины протекания реакции в единицу времени в единице объема:
, ni- число молей, в мом. времени t, ni0-в начале., ni-стехиом. коэф. (для исх. в-в берется с -, прод с +). Скорость гомогенной хим. реакции – скорость изменения глубины протекания реакции в единицу времени в единице объема:  . Скорость реакции по i-ому компоненту:
. Скорость реакции по i-ому компоненту:  .,
.,  . Для системы с постоянным объемом:
. Для системы с постоянным объемом: 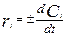 . Используют +, если скорость определяется по образующемуся компоненту и наоборот.
. Используют +, если скорость определяется по образующемуся компоненту и наоборот.
Под кинетической кривой понимают график зависимости концентрации реагента или продукта от времени.
Уравнение, описывающее зависимость скорости хим. процесса от С называется кинетическим уравнением процесса. Основной постулат химической кинетики(закон действующих масс – Гульдберг и Вааге): скорость реакции в каждый момент времени при постоянной температуре ~ произведению концентраций реаг-х в-в, возведенных в некоторые степени.  ,
,  . Коэффициент пропорциональности k – константа скорости реакции.
. Коэффициент пропорциональности k – константа скорости реакции.
Константы сильно зависят от Т. Показатель степени – порядок реакции по дан. реаг. Общий пор. реак. q=n+m. Для элем. реакции порядок по дан. реаг. = числу частиц, участвующих в превращении. Лимитирующая стадия – самая медленная стадия сложной ХР.
Константа скорости р-ции:
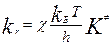 , c- трансмиссионный коэффициент (учитывает вероятность перехода АК в продукты р-ции)
, c- трансмиссионный коэффициент (учитывает вероятность перехода АК в продукты р-ции)
Методы определения порядка реакции. Время (период) полупревращения. ДиФФеренциальные и интегральные уравнения скорости нулевого, первго и второго порядка.
Время (период) полупревращения – время, необходимое для хим. превращения половины начального кол-ва компонента.
Методы определения порядка реакции: Метод подстановки – подстановка экс. данных в какое-либо из известных уравнений. Прав-ть выбора опред. по тому, как хорошо сохраняется константа скорости.
Метод Вант-Гоффа (опр-е по нач. скоростям): Если проходит реакция А+В->Прод-ты, то  . Для опр. пор. по в-ву А проводят серию эксп. при пост. нач. конц. в-ва В и различных нач. конц. А.
. Для опр. пор. по в-ву А проводят серию эксп. при пост. нач. конц. в-ва В и различных нач. конц. А.  , где lgk’=lgk+lgCob*m. При различн. конц. А измеряют нач. скорости, смотря график зависимости lgr0 от lgCoA. Тангенс угла наклона равен порядку р-ции по А (tga=n). Аналогично для В. Можно оценить и расчетным путем, если известны нач. скорости при 2х нач. конц. в-ва:
, где lgk’=lgk+lgCob*m. При различн. конц. А измеряют нач. скорости, смотря график зависимости lgr0 от lgCoA. Тангенс угла наклона равен порядку р-ции по А (tga=n). Аналогично для В. Можно оценить и расчетным путем, если известны нач. скорости при 2х нач. конц. в-ва:  . Берем отношение скоростей, логарифмируем и выделяем n.
. Берем отношение скоростей, логарифмируем и выделяем n.
Метод определения по периоду полупревращения. Основан на зависимости ППП от начальной концентрации в-ва.
Влияние Т на скорость хим. реакций.
Основное влияние Т оказывает на константу скорости.
Кинетические ур-я односторонних реакций: реакции 0-го порядка. 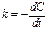 , интегрируя от начальной концентрации до конц. в мом. врем. t:
, интегрируя от начальной концентрации до конц. в мом. врем. t:  , С=С0-kt.,
, С=С0-kt., 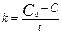 (св-ва сама!). 0-й порядок имеет место в тех сл., когда убыль в-ва в рез. протек. хим. реак. восполняется доставкой его из др. фазы. Реакции 1-го порядка:
(св-ва сама!). 0-й порядок имеет место в тех сл., когда убыль в-ва в рез. протек. хим. реак. восполняется доставкой его из др. фазы. Реакции 1-го порядка: 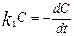 ,
,  => после преобразований:
=> после преобразований: 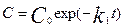 ,
,  . Среднее время жизни молекулы t=1/k1, соотв-ет уменьшению исх. конц. в е раз.
. Среднее время жизни молекулы t=1/k1, соотв-ет уменьшению исх. конц. в е раз.
Реакции 2-го порядка: 1. В р-ции участвуют 2 реагента, конц. кот. =.  ,
,  . 2. Начальные концентрации реагентов не равны:
. 2. Начальные концентрации реагентов не равны:  .
. 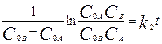 . 3. Р-ция 2А->P.
. 3. Р-ция 2А->P. 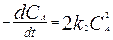 , множитель 2 означает, что в каждой элем. реакции превращаются 2 молекулы вещества А.
, множитель 2 означает, что в каждой элем. реакции превращаются 2 молекулы вещества А.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 710; Нарушение авторских прав?; Мы поможем в написании вашей работы!