
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Формула Больцмана
|
|
|
|
Распределения молекул по объему
Залетела одна молекула, она может находиться как в объеме один, так и в объеме два. Математическая вероятность такого события: P1=P2=1/2.
Залетело две молекулы P1*P2=1/2*1/2=1/4. Из таблицы следует WT1/WT2=P1/P2. Равномерное распределение молекул по V является не единственно возможным, а наиболее вероятным.
Молекулы системы совершают беспорядочное движение. Сл-но, число микросостояний определяет интенсивность хаотичного движения атомов и молекул
| № микро | V1 | V2 | Число микро | WT (ТД вер-сть) | P (мат вер-сть) |
| - | 1/4 | ||||
| ½ равномерное распределение | |||||
| - | 1/4 |
Энтропия – это ф-ия состояния системы. Приведенная теплота: dQ/T, где dQ- теплота получаемая телом в изотермическом процессе, Т- температура теплоотдающего тела, если система обратима, переходит из состояния А в В, то интеграл от приведенной теплоты не зависит от пути перехода из одного состояния в другое: 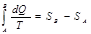 .
.
Для кругового обратимого процесса SВ=SA сл-но, 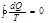 , dQ/T-полный дифференциал некоторой ф-ии S, которая определяется т-ко состоянием системы и не зависит от пути, которым система пришла в это состояние, сл-но, S-это ф-ия состояния. dQ/T=dS. Термен энтропия введен Клаузисом как мера способности теплоты превращаться в другие меры энергии, энтропия обладает свойством аддитивности: S системы =сумме составляющих систему.
, dQ/T-полный дифференциал некоторой ф-ии S, которая определяется т-ко состоянием системы и не зависит от пути, которым система пришла в это состояние, сл-но, S-это ф-ия состояния. dQ/T=dS. Термен энтропия введен Клаузисом как мера способности теплоты превращаться в другие меры энергии, энтропия обладает свойством аддитивности: S системы =сумме составляющих систему.
Энтропия идеального газа для изохоры: V=const, ΔS=Cv *ln(T2/T1).
Для изобары: P=const, ΔS=Cv *ln(T2/T1)+ R*ln(V2/V1).
Для изотермы: T=const, ΔS=R*ln(V2/V1).
Больцман доказал (1872), что между энтропией системы и термодинамической вероятностью её состояния существует связь, которая называется формулой Больцмана: S=k*lnP, где k – постоянная Больцмана.
|
|
|
Формула Больцмана позволяет дать статистическое истолкование второго закона термодинамики, утверждающего, что энтропия изолированной системы не убывает: термодинамическая вероятность состояния изолированной системы при всех происходящих в ней процессах не может убывать.
Следовательно, при всяком процессе, протекающем в изолированной системе,
Изменение термодинамической вероятности ее состояния ΔР положительно или равно нулю: ΔР = Р2-Р1 ≥0
Для обратимого процесса ΔР=0 и P= const, а в случае необратимого процесса ΔР>0 и Р возрастает. Следовательно, необратимый процесс — процесс, при котором система из менее вероятного состояния переходит в более вероятное, в пределе — в равновесноесостояние. Иначе его можно определить как процесс, обратный тому, при котором система из более вероятного состояния переходит в менее вероятное. Самопроизвольное протекание обратного процесса маловероятно, хотя в принципе и возможно. Чтобы он произошел, требуется одновременное протекание компенсирующего процесса вовнешних телах. По второму закону термодинамики, компенсирующий процесс должен быть таким, чтобы термодинамическая вероятность состояния системы всех тел, участвующих в осуществлении обратного и компенсирующего процессов, возрастала.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 3842; Нарушение авторских прав?; Мы поможем в написании вашей работы!