
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства неразбавленных растворов неэлектролитов
|
|
|
|
Энергетические эффекты процессов растворения
Энергетической характеристикой растворения является теплота образованияраствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются:
– поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах;
– выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание).
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты – проводящие электрический ток, и неэлектролиты – не проводящие электрический ток, в силу отсутствия в них ионов.
Для описания свойств разбавленных растворов неэлектролитов используют модель идеального раствора.
Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы.
Образование этих растворов сопровождается нулевым тепловым эффектом, и каждый компонент в растворе ведет себя независимо от других компонентов. К идеальным растворам по свойствам приближаются очень разбавленные растворынеэлектролитов. К общим свойствам таких растворов относятся понижение давления насыщенного пара растворителя над раствором и температура замерзания, повышение температуры кипения и осмотическое давление.
Допустим, что из раствора при изменении температуры испаряется или кристаллизуется только растворитель, и, что растворенное вещество является неэлектролитом.
|
|
|
7.4.1. Закон Рауля
Над жидкостью всегда имеется пар в результате естественного процесса испарения. Пар, находящийся в равновесии с жидкостью называется насыщенным. При определенных условиях в системе: Н2О(ж) = Н2О(пар) устанавливается равновесие. Если в эту равновесную систему ввести нелетучее вещество, то концентрация растворителя уменьшится. Это вызовет нарушение равновесия системы. По принципу Ле-Шателье начинает протекать противодействующий процесс, приводящий к конденсации паров воды. Это снижает давления пара. Т.е. давление пара над раствором (р) всегда меньше, чем над чистым растворителем (р 0). Разность (р 0 – р) = Δ р представляет понижение давления пара над раствором. Отношение (р 0 – р)/ р 0 = Δ р / р 0 - относительное понижение давления пара над раствором.
В 1887 г. французский физик Рауль, изучая растворы нелетучих жидкостей, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией:
относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества Δ р/р0 = n/(n + N),
где n – число молей растворенного вещества; N – число молей растворителя.
Из закона Рауля возникают два следствия.
Первое следствие из закона Рауля.
Повышение температуры кипения Δ Т кип пропорционально моляльности раствора С m.
Δ Т кип. = К э С m,
где К э – эбуллиоскопическая постоянная растворителя;
С m – моляльная концентрация раствора;
Δ Т кип. = Т кип р-ра – Т кип.р-рителя.
Повышение температуры кипения обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя.
|
|
|
Второе следствие из закона Рауля.
Температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя.
Это обусловлено более низким давлением пара растворителя над раствором, чем над чистым растворителем. Понижение температуры замерзания (кристаллизации) Т зам пропорционально моляльности раствора
Δ Т зам = К к С m,
где К к – криоскопическая постоянная, зависящая от природы растворителя.
Используя эти уравнения можно определить молярную массу вещества по повышению температуры кипения раствора (метод эбуллиоскопии) или по понижению температуры замерзания раствора (метод криоскопии). Для этого экспериментально определяют повышение температуры кипения или замерзания раствора. Если известна масса растворенного вещества m B и растворителя m A, то молярную массу растворенного вещества М В определяют по уравнению
М в = 103 Кm B/(m AΔ T).
7.4.2. Осмотическое давление
Если привести в соприкосновение два раствора с разными концентрациями, то молекулы будут диффундировать преимущественно в том направлении, где их концентрация ниже. Двусторонняя диффузия приведет к выравниванию концентраций.
Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя.
Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом.
Схема осмометра представлена на рис. 20.
Столб жидкости с высотой h образовался за счет осмоса. Осмос прекращается тогда, когда скорости перехода молекул растворителя в обоих направлениях становятся равными. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади полупроницаемой перегородки, заставляющей молекулы растворителя проникать через нее. При равновесии внешнее давление и осмотическое давления уравновешены. Если внешнее давление, приложенное к более концентрированному раствору, будет выше осмотического, то скорость перехода молекул растворителя из концентрированного раствора будет больше, и растворитель будет переходить в разбавленный раствор. Этот процесс называется обратным осмосом, используется для очистки природных и сточных вод, для получения питьевой воды из морской. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа
|
|
|
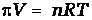 или
или 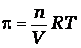 .
.
Откуда
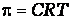 ,
,
где π-осмотическое давление; С – молярная концентрация раствора.
С = n/V, n = m/M, С = m/MV.
При определении осмотического давления можно провести следующую аналогию с давлением газа.
Известно, что 1 моль газообразного вещества при 0º С и давлении 101,3 кПа занимает объем 22,4 л. Аналогично, можно утверждать, что 1 моль вещества, растворенный в 22,4 л растворителя при 0º С развивает осмотическое давление 101,3 кПа. Это уравнение позволяет по величине осмотического давления раствора определять молярную массу (и относительную молекулярную массу) растворенного вещества.
Пример. Осмотическое давление раствора, в 250 мл которого содержится 3 грамма сахара, при 12º С равно 83,14 кПа. Определить относительную молекулярную массу сахара.
Решение: Известные данные подставляем в уравнение Вант-Гоффа, получаем
83,14 . 0,25 = 3.8,314 . (273 + 12)/Мв,
откуда Мв = 342 г/моль. А относительная молекулярная масса сахара равна 342.
7.4.3. Значение осмоса
Осмос играет важную роль в биологических процессах, обеспечивая поступление воды в клетки.
Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного – гипотоническим.
Гипертонические растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, т.к. вызывают удаление воды из микроорганизмов.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 441; Нарушение авторских прав?; Мы поможем в написании вашей работы!