
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислородный электрод
|
|
|
|
Водородный электрод
| Схема | 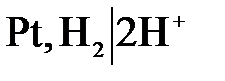 . .
|
| Уравнение электродной реакции | 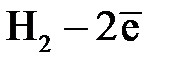 D D  . .
|
| Схема | 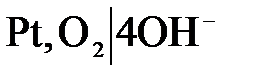
|
| Уравнение электродной реакции |  D D 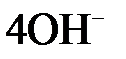
|
25.Расчет численных значений φрэл-дов. Уравнение Нернста. Стандартные электродные потенциалы и их определение (φрэл-дов). Ряд напряжений металлов.
Сопоставить свойства электрохимических систем по их потенциалам можно тогда, когда они находятся в одинаковых условиях. Для этого пользуются понятием стандартного электродного потенциала.
Стандартным электродным потенциалом (φ o, В) называется потенциал, измеренный при стандартных условиях (давление 101,3 кПа, температура 298 К, концентрация потенциалопределяющих ионов 1 моль/л) относительно электрода сравнения. Электродом сравнения является водородный электрод (Pt,H2│H2SO4) в растворе H2SO4 с СH+ = 1 моль/л при давлении Р = 101,3 кПа.
Потенциал электрода в условиях, отличных от стандартных, можно рассчитать по уравнению Нернста.
Электроды, обратимые относительно своих ионов в растворе электролитаф, называется электродомо 1-ого рода, к ним относятся металлический и газовые электроды: водный, кислородный.
Ме электроды
 :
:

Водородный электрод
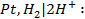

КИСЛОРОДНЫЙ ЭЛЕКТРОД

О2+2Н2О+4е<=>4OH-
УРАВНЕНИЕ НЕРНСТА
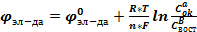 , где
, где 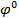 стандрастный электродный потенциал,В
стандрастный электродный потенциал,В
R= 8.314 Дж/моль*К
Т=темпер в К
F – постоянная Фарадея; F=96500Кл
n – число электронов
 и
и  - концентрация ОФ(
- концентрация ОФ(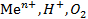 ) и ВФ(
) и ВФ(
Переходя от ln к lg и представляя R и F при Т=298К, получаем:
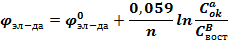
26.Частные уравнения Нернста для металлических, водородного и кислородного электродов (с выводом).
Потенциал электрода в условиях, отличных от стандартных, можно рассчитать по уравнению Нернста.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 5277; Нарушение авторских прав?; Мы поможем в написании вашей работы!