
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации растворов
|
|
|
|
526.
524.
509.
508.
507.
506.
505.
504.
| Название комплекса | Комплекс | КО | СО | КЧ | Заряд |
| Тетрахлороплатинат(II) аммония | (NH4)2[Pt(Сl)4] | платина | +2 | -2 | |
| Нитрат пентаамминроданокобальта(III) | [Co(NH3)5СNS](NO3)2 | кобальт | +3 | +2 | |
| Гексабромоплатинат(IV)тетрааквацинка(II) | [Zn(H2O)4][PtBr6] | Цинк-платина | +2 +4 | +2 -2 |
| Название комплекса | Комплекс | КО | СО | КЧ | Заряд |
| Гексагидроксоалюминат калия | K3[Al(OH)6] | Алюминий | +3 | -3 | |
| Гидросульфат пентаамминнитратокобальта(III) | [Co(NH3)5NO3](HSO4)2 | Кобальт | +3 | +2 | |
| Гексахлороплатинат(IV) гексаакважелеза(II) | [Fe(H2O)6][PtCl6] | железо-платина | +2 +4 | +2 -2 |
| Название комплекса | Комплекс | КО | СО | КЧ | Заряд |
| гексацианоферрат(III) натрия | Na3[Fe(CN)6] | Железо | +3 | -3 | |
| Бромид гексааминхрома(III) | [Cr(NH3)6]Br3 | Хром | +3 | +3 | |
| Гексафтороманганат(IV) тетраакваникеля(II) | [Zn(H2O)4][MnF6] | Цинк-марганец | +2 +4 | +2 -2 |
| Комплекс | Название комплекса | Особенности |
| [Cr(H2O)5Cl](NO3)2 | Гексааквахлорохром(III) нитрат | Соль, катионное, смешанное. |
| H[AuCl4] | Водорода тетрахлороаурат(III) | Кислота, анионное, ацидокомплексное. |
| [Cu(NH3)4](OH)2 | Тетраамминмедь(II) гидроксид | Основание, катионное, амминокомплексное |
| [Fe(H2O)6]SO4 | Гексаакважелезо(II)сульфат | Соль, катионное, аквакомплекс |
| Комплекс | Название комплекса | Особенности |
| H2[SiF6] | Гексааквахлорохром(III) нитрат | Кислота, анионное, ацидокомплексное |
| [Zn(NH3)4](OH)2 | Водорода тетрахлороаурат(III) | Основание, катионное, амминокомплексное. |
| Na[Co(NH3)2(NO2)4] | Тетраамминмедь(II) гидроксид | Соль, анионное, смешанное. |
| [Fe(H2O)6]2(SO4)3 | Гексаакважелезо(III)сульфат | Соль, катионное, аквакомплекс |
| Комплекс | Название комплекса | Особенности |
| H2[Pt(CN)6] | Водорода гексацианоплатинат(IV) | Кислота, анионное, ацидокомплексное. |
| [Co(SO4)(NH3)5]NO3 | Пентаамминсульфаткобальта(III) нитрат | Соль, катионное, смешанное. |
| [Pd(H2O)4]Cl2 | Тетрааквапалладий(II)хлорид | Соль, катионное, аквакомплекс |
| [Cd(NH3)4](OH)2 | Тетраамминкадмий(II) гидроксид | Основание, катионное, амминокомплексное |
510. Сульфат меди CuSO4, вода H2O, газообразный аммиак NH3. Необходимо растворить сульфат меди, пропустить через раствор аммиак - образуется комплекс:
|
|
|
CuSO4(тв) + H2O = CuSO4(ж),
CuSO4(ж) + NH3(г) = [Cu(NH3)4](SO4)
511. Нитрат ртути Hg(NO3)2, вода H2O, иодид калия KI. Необходимо растворить соли в воде, к нитрату ртути добавить иодид калия - выпадет осадок. Прилить иодида до полного растворения осадка - образовалась комплексная соль:
Hg(NO3)2(тв) + H2O = Hg(NO3)2(ж),
KI(тв) + H2O = KI(ж),
Hg(NO3)2(ж) + KI(ж) = HgI2(тв) + 2KNO3.
HgI2(тв) + 2 KI(ж) = K2[HgI4]
512. Co3+, NH3, NO2-, K+
| Комплекс | Название |
| [Co(NH3)6](NO2)3 | Гексаамминкобальт(III) нитрит |
| [Co(NH3)5(NO2)](NO2)2 | Пентаамминнитритокобальт(III) нитрит |
| [Co(NH3)4(NO2)2](NO2) | Тетраамминдинитритокобальт(III) нитрит |
| [Co(NH3)3(NO2)3] | Триамминтринитритокобальт(III) |
| K[Co(NH3)2(NO2)4] | Калия диамминтетранитритокобальтат(III) |
| K2[Co(NH3)(NO2)5] | Калия амминпентанитритокобальтат(III) |
| K3[Co(NO2)6] | Калия гексанитритокобальтат(III) |
513. Поскольку из раствора комплекса осаждается сульфат бария, то барий находится во внешней сфере комплекса: Ba[Cu(SCN)2(CN)2] - бария дицианодироданокупрат(II).
Ba[Cu(SCN)2(CN)2] + H2SO4 = BaSO4 + H2[Cu(SCN)2(CN)2]
514. Поскольку комплекс реагирует с нитратом серебра в соотношении 1:1, то во внешней сфере комплекса находится 1 атом хлора: [Pt(NH3)3Cl3]Cl - триамминдихлорплатина(IV). [Pt(NH3)3Cl3]Cl + AgNO3 = AgCl + [Pt(NH3)3Cl3]NO3.
515. Данные сложные соединения представляют собой комплексные соли, различающиеся между собой устойчивостью. Первый комплекс K[Fe(SO4)2] малоустойчив, т.е. в его растворе присутствуют катионы железа, а второй комплекс железа K3[Fe(CN)6] устойчив настолько, что в растворе нет катионов железа, способных реагировать с роданидом калия. Fe3+ + 3CNS- = Fe(CNS)3 - красный роданид железа.
|
|
|
516. При хранении на воздухе сульфат меди превращается в комплекс, который имеет синюю окраску (медный купорос): CuSO4 + 5H2O = [Cu(H2O)5]SO4.
517. Гексацианоферрат(II) калия и сульфат меди: K4[Fe(CN)6] + CuSO4 = Cu2[Fe(CN)6]. Образуется комплексная соль - гексацианоферрат(II) меди, которая нерастворима. [Fe(CN)6]+4 + Cu+2 = Cu2[Fe(CN)6].
518. 5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O. Образовался K3[Fe(CN)6] - гексацианоферрат(III) калия.
519. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Co(CN)6]3- , т.к. z (Co = 3) > z (Co = 2). В случае б) прочнее [Co(CN)6]4-, т.к. CN- - лиганд сильного поля. в) прочнее [ZrF6]2- , т.к. r (Ti)< r (Zr).
520. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Zn(NH3)4]2- , т.к. NH3 - лиганд сильного поля. В случае б) прочнее [Hg(CN)4]2-, т.к. CN- - лиганд сильного поля. в) прочнее [Cu(NH)3]2+ , т.к. z (Cu2+)< z (Cu+).
521. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Zn(СN)4]2- , т.к. CN - лиганд сильного поля. В случае б) прочнее [BeF4]2-, т.к. F – ионы более сильные лиганды, чем Cl-ионы. в) прочнее [Zr(CN)6]2- , т.к. z (Ti+4)< z (Zr4+).
522. н
523. Взаимодействие между центральным атомом Ni и лигандами (NH3) происходит по донорно-акцепторному механизму.
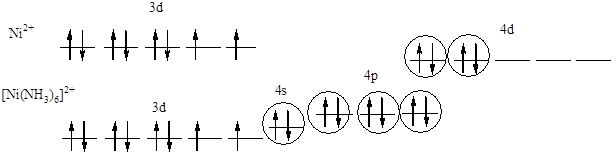
|
В образовании гибридных облаков участвуют вакантные 4s-, 4p-, 4d-орбитали иона Ni2+ и электронные пары атомов азота. Т.о., гибридизуются одна s-, три р-орбитали и две 4d-орбитали, тип гибридизации комплекса: sp3d2, геометрия: октаэдр, парамагнетизм комплекса определяется наличием 2 неспаренных электронов на 3d-орбитали атома никеля.

|
Взаимодействие между центральным атомом Ni и лигандами (Cl) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные 4s- и 4p- орбитали иона Ni2+ и электронные пары атомов хлора. Т.о., гибридизуются одна s- и три р-орбитали, тип гибридизации комплекса: sp3, геометрия: тетраэдр, парамагнетизм комплекса определяется наличием 2 неспаренных электронов на 3d-орбитали атома никеля.[Ni(CN)4]2- Взаимодействие между центральным атомом Ni и лигандами (CN) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные 4s- и 4p- орбитали иона Ni2+ и электронные пары атомов азота. Т.о., гибридизуются одна s-, две р-орбитали и одна 3d-орбиталь, тип гибридизации комплекса: dsp2, геометрия: плоский комплекс. Т.к. на 3d-орбиталях атома никеля нет неспаренных электронов, то комплекс диамагнитен.
|
|
|
525.  Взаимодействие между центральным атомом Fe и лигандами (CN) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные3d-, 4s- и 4p- орбитали иона Fe2+ и электронные пары атомов азота. Т.о., гибридизуются одна s-,три р- и две d- орбитали, тип гибридизации комплекса: d2sp3, геометрия: октаэдр. На 3d - орбиталях атома железа нет неспаренных электронов, поэтому комплекс диамагнитен.
Взаимодействие между центральным атомом Fe и лигандами (CN) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные3d-, 4s- и 4p- орбитали иона Fe2+ и электронные пары атомов азота. Т.о., гибридизуются одна s-,три р- и две d- орбитали, тип гибридизации комплекса: d2sp3, геометрия: октаэдр. На 3d - орбиталях атома железа нет неспаренных электронов, поэтому комплекс диамагнитен.

|
Взаимодействие между центральным атомом Mn и лигандами (Н2О) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные3d-, 4s- и 4p- орбитали иона Mn2+ и электронные пары атомовкислорода. Т.о., гибридизуются одна s-,три р- и две d- орбитали, тип гибридизации комплекса: d2sp3, геометрия: октаэдр. На 3d - орбиталях атома марганца есть один неспаренный электрон, поэтому комплекс парамагнитен.
527.
528. Цветность комплексов объясняется наличием неспаренных электронов на расщепленных под действием лигандов d-орбиталях. Неспаренный электрон может возбуждаться под действием кванта света и переходить на свободную расщепленную орбиталь – соединение приобретает цветность. Так,
529. Сила лиганда в комплексе определяет его спин. Если лиганд слабого поля, как в случае с комплексом [CoF6]3-, то заполнение расщепленных d-подуровней происходит по правилу Хунда, вкруговую. Если лиганд сильного поля, как в [Co(NH3)6]3+ , то расщепленные подуровни заполняются против правила, сначала низ, а за тем верх, и комплекс имеет низкий спин.
|
|
|
рисунок
530. В случае лиганда сильного поля, например СО, NH3, расщепленные d-подуровни центрального атома заполняются против правила Хунда, сначала низ, а за тем верх. Это случай а). Например, [Fe(NH3)4]2-. В случае лиганда слабого поля, например F-, OH-, заполнение расщепленных d-подуровней происходит по правилу Хунда, вкруговую. Это случай б). Например, [CoF6]3 .
531. Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Массовая доля растворенного вещества - количество грамм растворенного вещества, содержащееся в 100 граммах раствора. Например, концентрация спирта 40% означает, что в 100 граммах водки содержится 40 грамм спирта. 1%-ный раствор иода означает, что 100 грамм раствора содержат 1 грамм иода.
| Дано V(раствора)=10л. W%(KOH)= 40% ρ = 1.40 г.мл | Найдем массу раствора: m = V*ρ = 10000*1.4 = 14000 г. В растворе должно содержаться: m(KOH) = 14000*40%/100% = 5600 грамм, m(H2O) = 14000 - 5600 = 8400 грамм. |
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1415; Нарушение авторских прав?; Мы поможем в написании вашей работы!