
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов
590.
589.
588.
587.
586.
585.
584.
583.
582.
581.
580.
579.
578.
577.
576.
575.
574.
573.
572.
571.
570.
569.
568.
567.
566.
564.
563.
562.
561.
| Дано: m(NH4Cl) = 10 г. V(Н2О) = 233 мл. ∆T = -2.8oC Суд = 4.2 Дж/(г*К) | n(NH4Cl) = m/M = 10*53.5 = 0.19 моль.
Qраств(NH4OH) = m(раствора)*∆Т*Cуд = (10+233)*2.8*4.2 = -2.86 кДж
∆Hoраств = 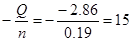 кДж/моль. кДж/моль.
|
| Дано: m(NaOH) = 10 г. V(Н2О) = 250 мл. ∆Hoраств(NaOH) =?. ∆Т = 6.7оС Суд = 4.2 Дж/(г*К) |
n(NaOH) = m/M = 10*40 = 0.25 моль.
Qраств(NaOH) = m(раствора)*∆Т*Cуд = (10+250)*6.7*4.2 = 7.32 кДж
∆Hoраств = 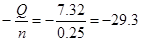 кДж/моль. кДж/моль.
|
| Дано: m(CaCl2) = 10 г. Q = 6.82 кДж m(CaCl2*6H2O) = 10г. Q = -0.87 кДж ∆Hoгидр(СaCl2) =? | n(CaCl2) = m/M = 10/111 = 0.09 моль. ∆Hoраств(CaCl2) = -Q/n = -6.82/0.09 = -75.7 кДж/моль n(CaCl2*6Н2О) = m/M = 10/219 = 0.046 моль. ∆Hoраств(CaCl2*6Н2О) = -Q/n = 0.87/0.046 = 19.05 кДж/моль ∆Hoгидр(СaCl2) = ∆Hoраств(CaCl2) - ∆Hoраств(CaCl2*6Н2О) = -94.75 кДж/моль |
| Дано: ∆Hoраств(CuSO4*5H2O)=11.72 кДж/моль. V(Н2О) = 0.2 литра. ∆Т = 2оС Суд = 4.2 Дж/(г*К) m(CuSO4) = 4 г. | n(CuSO4) = m/M = 4/160 = 0.025 моль Q = m(раствора)*∆Т*Cуд = (200+4)*2*4.2 = 1.71 кДж ∆Hoраств(CuSO4) = -Q/n = – 1.71/0.025 = -68.5 кДж/моль ∆Hoгидр(СuSO4) = ∆Hoраств(CuSO4) - ∆Hoраств(CuSO4*5Н2О) = -68.5 – 11.72 = -80.22 кДж/моль |
565.
| Дано: ∆Hoрастворения(NH4NO3)=26.32 кДж/моль. V(Н2О) = 0.2 литра. ∆Т = 5оС Суд = 3.77 Дж/(г*К) m(NH4NO3) =? | Qраств(NH4NO3) = m(H2O)*∆Т*Cуд = 200*5*3.77 = 3.77 кДж
n = 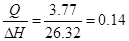 моль.
m(NH4NO3) = n*M = 0.14*80 = 11.46 грамм. моль.
m(NH4NO3) = n*M = 0.14*80 = 11.46 грамм.
|
| Дано: m(H2O) = 25 г m(NaCl) = 8,75 г S -? | Решение: 8,75 г NaCl – 25 г Н2О х г NaCl - 100 г Н2О х = 8,75*100/25 = 35 г NaCl/100г Н2О |
| Дано: V(Н2О) = 50 мл. n(Zn(NO3)2) = 0.003 моль | m(Zn(NO3)2) = n*M = 0.003*189 = 0.567 г.
Растворимость S = 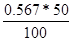 = 1.13 г/100 г воды = 1.13 г/100 г воды
|
| Дано: w(K2Cr2O7) = 45.2%. S -? | Возьмем 100 г раствора: m(K2Cr2O7) = 45.2 г, m(H2O) = 100 –45.2 = 54.8 г.
Растворимость S = 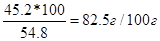
|
| Дано: S (KNO3) = 31.6 г/100 г w -? | Возьмем раствор, в котором m(KNO3) = 31.6 г, тогда m(H2O)=100 г.
w (KNO3) = 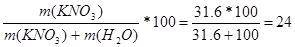 % %
|
| Дано: S (KNO3) = 55 г/100 г m(р-ра) = 60 г. m (KNO3) -? |
w (KNO3) = 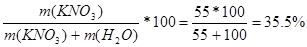 %
В 60 г раствора: m(KNO3) = (60*35.5) / 100 = 21.3 г. %
В 60 г раствора: m(KNO3) = (60*35.5) / 100 = 21.3 г.
|
| Дано: S1(K2CO3)= 155 г/100г S2(K2CO3)= 111 г/100г m(раствора) = 770 г. | Найдем, сколько грамм соли содержится в 770 граммах раствора при 100оС. m1(K2CO3) = 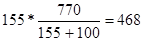 грамм, следовательно воды в растворе содержится 770 – 468 = 302 грамма. Найдем, сколько соли может растворится в 302 г. воды при 00С: m2(K2CO3) = грамм, следовательно воды в растворе содержится 770 – 468 = 302 грамма. Найдем, сколько соли может растворится в 302 г. воды при 00С: m2(K2CO3) = 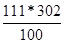 =335г.
Т.е. при охлаждении из раствора выделится 468 – 335 = 133 гр. соли. =335г.
Т.е. при охлаждении из раствора выделится 468 – 335 = 133 гр. соли.
|
| Дано: S1(Pb(NO3)2)= 90 г/100г S2(Pb(NO3)2)= 46 г/100г V(H2O) = 200 мл T = 200C | При 60оС в 200г воды растворяется m1(Pb(NO3)2) = 90*200/100 = 180г При 0оС в 200г воды растворяется m1(Pb(NO3)2) = 46*200/100 = 92 г. В осадок выпадет m1-m2 = 180 – 192 = 92 грамма соли. |
| Дано: Т1 = 100оС, Т2 = 20оС S1(NaNO3) = 176 г/100г S2(NaNO3) = 88 г/100г m(NaNO3) = 120 г. | Найдем массовую долю соли в растворе при обеих температурах: w1% = 176*100%/(176+100) = 63,8%; w2% = 88*100%/(88+100) = 46,8% Пусть m1(р-ра) = х, m2(р-ра) = у, m1(NaNO3) = z, m2(NaNO3) = k. По условию: х-у = 120, z-k = 120 грамм. x = z*100%/w1% = z*1.57, y = k*100%/w2% = k*2.14. Получаем систему уравнений: z*1.57 – k*2.14 = 120иz-k =120. Решая ее, получаем х = 357,4 грамм; z = 228 грамм. |
| Дано: S(H2S) = 2.91 P = 101325 Па T = 200C W%(CO2) =? | В одном литре воды растворяется 2.91 литра H2S.
m(H2O) = 1000 г.
n(H2S) = V/Vм = 2.91/22.4 = 0.13 моль
m(H2S) = n*M = 0.13*34 = 4.42 г.
w%(H2S) = 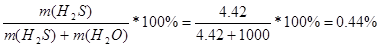
|
| Дано: S(CO2) = 0.878 P =? W%(CO2) = 1 % | В одном литре воды растворяется 0.878 литр диоксида углерода. m(H2O) = 1000 г. n(CO2) = V/Vм = 2.91/22.4 = 0.13 моль m(CO2) = n*M = 0.13*44 = 5.72 г. |
| Дано: W%(C12H22O11) = 10% Т = 100оС Ро = 101.3*105 Па Р’ =? | Ро - Р’ = Ро 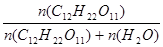 Возьмем 1 кг раствора. m(C12H22O11) = 100 г.
n(C12H22O11) = m/M = 100/342 = 0.292 моль
m(H2O) = 1000-100 = 900 г.
n(H2O) = 900/18 = 50 моль.
101.3*105 - Р’ = 101.3*105
Возьмем 1 кг раствора. m(C12H22O11) = 100 г.
n(C12H22O11) = m/M = 100/342 = 0.292 моль
m(H2O) = 1000-100 = 900 г.
n(H2O) = 900/18 = 50 моль.
101.3*105 - Р’ = 101.3*105 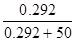 Р’=1.007*105 Па = 755.6 мм.рт.ст. Р’=1.007*105 Па = 755.6 мм.рт.ст.
|
| Дано: Р0 = 8199.325 Па V(H2O) = 540 мл m(C6H12O6) = 1 г. P’ =? | Po - P’ = P0*N(C6H12O6)
n(H2O) = m/M = 540/18 = 30 моль.
n(С6H12O6) = m/M = 36/180 = 0.2 моль.
8199.325 - P’ = 8199.325* 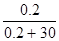 , следовательно, P’ = 8145.025 Па , следовательно, P’ = 8145.025 Па
|
| Дано: Р0 = 23939.35 Па P’ = 21854.4 Па m(ацетона) = 200 г. m(неэлект.)=10.5 г. М =? | Po - P’ = P0*N2
n(ацетона) = m/M = 200/58 = 3.45 моль.
.
23939.35 – 21854.4 = 23939.35*  , следовательно, n (неэлектр.) = 0.329 моль, М(неэлектр.) = m / n = 10.5 / 0.329 = 32 г/моль. , следовательно, n (неэлектр.) = 0.329 моль, М(неэлектр.) = m / n = 10.5 / 0.329 = 32 г/моль.
|
| Дано: Р0 = 47375 Па P’ = 33310 Па n(в-ва) = 1 n(H2O) =? | Po - P’ = P0*N(вещества) => 47375 - 33310 = 47375* 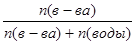 1+n(H2O) = 3.37 => n(H2O) = 2.37 моль.
1+n(H2O) = 3.37 => n(H2O) = 2.37 моль.
|
| Дано: w(С2Н5ОН)=25% Тзам-? | КН2О*См, где См-моляльность р-ра или моль в-ва на 1кг растворителя. КН2О = 1,86. Возьмем 100 грамм раствора, тогда масса этанола будет 0,25*100 = 25 г, а количество в-ва его n = m/M = 25/46 = 0,54 моль. Масса воды тогда будет 100-25 = 75 грамм. Тогда См = n(C2H5OH)/M(H2O) = 0,543/75*10-3 = 7,25 моль/кг. DТзам = 1,86*7,25 = 13,480. Тзам = -13,480С |
| Дано: W%(C6H12O6) = 10% Т(кип) =? | ΔТ(кип) = Е(Н2О)*Сm, где Сm - моляльная концентрация. Найдем моляльность раствора глюкозы: возьмем 100 грамм раствора m(C6H12O6) = 10 г. n(C6H12O6) = m/M = 10/180 = 0.056 моль m(H2O) = 100-10 = 90 г. Сm = n(C6H12O6)/m(H2O) = 0.056/0.090 = 0.62 моль/кг. ΔТ(кип) = Е(Н2О)*Сm = 0.52*0.62 = 0.320. Т(кип) = 100.32 0С |
| Дано: m(x) = 1.6 г. V(H2O) = 250 мл. Т(зам) = -0.2 оС М(х) =? | ΔТ(зам) = К(Н2О)*Сm = 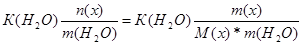 0.2 = 1.86*
0.2 = 1.86* 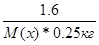 , следовательно, М(х) = 59.52 г/моль , следовательно, М(х) = 59.52 г/моль
|
| Дано: m(x) = 27 г. V(H2O) = 1000 мл. Т(кип) = 100.78 оС М(х) =? | ΔТ(кип) = Е(Н2О)*Сm = 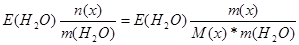 0.78 = 0.52*
0.78 = 0.52* 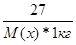 , следовательно, М(х) = 18 г/моль , следовательно, М(х) = 18 г/моль
|
| Дано: m(Ix) = 9.2 г. m(CH3OH) = 100 г. То(кип) = 64.7 оС Т’(кип) = 65 оС М(Iх) =? Е(CН3ОH) = 0.84 | Необходимо найти молярную массу иода, растворенного в метаноле
ΔТ(кип) = Е(CН3ОH)*Сm =  65 - 64.7 = 0.84*
65 - 64.7 = 0.84* 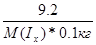 , следовательно, М(Iх) = 257.6 г/моль
Молекула иода состоит из 257.6/127 = 2 атомов. , следовательно, М(Iх) = 257.6 г/моль
Молекула иода состоит из 257.6/127 = 2 атомов.
|
| Дано: m(Sx) = 0.81 г. m(C6H6) = 100 г. ΔТ(кип) = 0.081 оС М(Sх) =? Е(C6H6) = 2.57 | Необходимо найти молярную массу серы, растворенной в бензоле
ΔТ(кип) = Е(C6H6)*Сm = 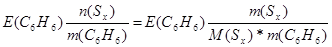 0.081 = 2.57*
0.081 = 2.57* 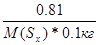 , следовательно, М(Sх) = 257 г/моль
Молекула серы состоит из 257/32 = 8 атомов. , следовательно, М(Sх) = 257 г/моль
Молекула серы состоит из 257/32 = 8 атомов.
|
| Дано: V(H2O) = 30 л. V(C3H5(OH)3) = 9 л. Т(зам) =? p(глицерина) = 1,261 г/мл | ΔТ(зам)=К(Н2О)*Сm= 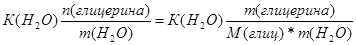 Масса глицерина равна m = V*p = 9000*1.261 = 11349 г.
ΔТ(зам) = 1.86*
Масса глицерина равна m = V*p = 9000*1.261 = 11349 г.
ΔТ(зам) = 1.86* 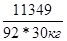 = 7.65о. Раствор замерзает при -7.65оС = 7.65о. Раствор замерзает при -7.65оС
|
| Дано: Т(зам) = -150С m(C2H4(OH)2)=? | ΔТ(зам)=К(Н2О)*Сm= 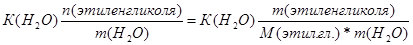 Сm =
Сm = 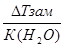 = = 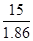 =8.06 моль / кг растворителя.
m(этил.гл.) = Сm * М(этил.гл.) * m(H2O) = 8.06*62*1 = 499.7 г = 0.5 кг. =8.06 моль / кг растворителя.
m(этил.гл.) = Сm * М(этил.гл.) * m(H2O) = 8.06*62*1 = 499.7 г = 0.5 кг.
|
| Дано: Pосм =? w%(сахара) = 4 % Т = 20оС = 293 К p = 1.014 г/мл | Pосм = См*R*T Возьмем 1 литр раствора и найдем См сахара: m(раствора) = V*p = 1000*1.014 = 1014 г. m(сахара) = 1014*4%/100% = 40.56 г. См(сахара) = m/(M*V) = 40.56/(342*1) = 0.12 моль/л Росм = 0.12*8.31*293 = 288.8 кПа, Росм = 0.12*0.082*293 = 2.85 атм. |
| Дано: V(H2O) = 1 л. Pосм = 607950 Па m(глюкозы) = 45 г. Т =? | Pосм = См*R*T = 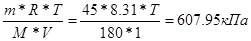 , следовательно Т=293.6К , следовательно Т=293.6К
|
| Дано: W%(C) = 39.56 % W%(H) = 7.69 % W%(O) = 52.75 % V(H2O) = 1 л. Pосм = 9.00*105 Па m(маннита) = 72 г. Т = 00С = 273 К | Pосм = См*R*T = 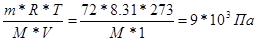 М(маннита) = 181 г/моль
Возьмем 1 моль маннита. Масса одного моль маннита 181 грамм. В них содержится:
m(C) = 39.56%*181/100% = 72 г. n(С) = m/M = 72/12 = 6 моль
m(Н) = 7.69%*181/100% = 14 г. n(Н) = m/M = 14/1 = 14 моль
m(О) = 52.75%*181/100% = 96 г. n(О) = m/M = 96/16 = 6 моль
Формула маннита: С6Н14О6
М(маннита) = 181 г/моль
Возьмем 1 моль маннита. Масса одного моль маннита 181 грамм. В них содержится:
m(C) = 39.56%*181/100% = 72 г. n(С) = m/M = 72/12 = 6 моль
m(Н) = 7.69%*181/100% = 14 г. n(Н) = m/M = 14/1 = 14 моль
m(О) = 52.75%*181/100% = 96 г. n(О) = m/M = 96/16 = 6 моль
Формула маннита: С6Н14О6
|
591. Электролитами называются вещества, диссоциирующие в растворе. Согласно теории электролитической диссоциации, кислоты- вещества, которые при диссоциации дают катионы водорода. Основания при диссоциации дают ОН-группы. Соли диссоциируют на катион и анион кислотного остатка. Кислые и основные соли называют промежуточными соединениями, т.к. они являются продуктами неполной реакции нейтрализации.
592. Возможность электролитической диссоциации определяется природой вещества (сильный или слабый электролит), природой растворителя, температурой и т.п. Ионизирующую силу растворителя характеризует диэлектрическая проницаемость: вода – 81.0, спирт – 25.8, бензол – 2.23, фтороводород – 32.3. Диссоциация NaCl:
NaCl + H2O = 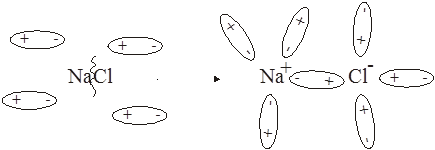
|
593. В воде хлорид натрия диссоциирует на ионы практически полностью, а спирт практически не диссоциирует. Т.к. ионы, образующиеся при диссоциации, проводят электрический ток, то раствор NaCl проводит электрический ток, а раствор CH3CH2OH не проводит.
594. Для количественной характеристики электролитической диссоциации применяются константа диссоциации (Кд) и степень диссоциации (а). Кд – отношение произведения концентраций продуктов к произведению концентраций исходных веществ. а – отношение количества диссоциированных молекул к исходному количеству молекул. Постоянной величиной при различных концентрациях является Кд.
595. По величине электролитической диссоциации электролиты делятся на: сильные (Кд >>1), средние (1> Кд > 10-2) и слабые (Кд << 1). К первым относится HNO3(Кд = 43.6): HNO3 = H+ + NO3- . Ко вторым – HIO4 (Кд = 2/3*10-2): HIO4 = H+ + IO4-. К слабым электролитам относят NH4OH (Кд = 1.76*10-5): NH4OH = NH4+ + OH-.
|
|
Дата добавления: 2015-04-24; Просмотров: 364; Нарушение авторских прав?; Мы поможем в написании вашей работы!