
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Важнейшие окислители и восстановители
|
|
|
|
Реакция диспропорционирования (примеры)
Диспропорционирования реакция – это реакция, при которой вещества, находящиеся в промежуточных степенях окисления могут принимать участие в реакциях, в которых одна часть окисляется, а другая – восстанавливается, причем у одного и того же вещества может быть разная степень окисления.
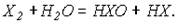
Где x –Cl. В соединении с водородом ст.ок. = +1, а с кислородом и водородом=-1.
№26.
Важнейшие восстановители: низшие степени окисления
1) Me: Аl, Mg, Na, K, Zn. Соединения с Me: Cu+, Sn2+, Fe2+.
2) неMe: С, CO, H2
Важнейшие окислители: высшие степени окисления
1) соединения Me: PbO2, KMgO4/
2) неMe: O2, Cl2, Br2. соединения неMe: HCl, HNO3, N2SO4
№27.
Гальванический элемент - устройство, используемое для преобразования энергии окислительно-восстановительной химической реакции в электрическую энергию. Химический источник электрического тока.
Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита.
Элемент Якоби-Даниэля, представляет собой пример электрохимического (гальванического) элемента – устройства, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Их называют также химическими источниками электрической энергии (ХИЭЭ).
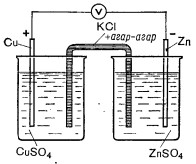
Cu – (K), Zn – (A). Работает, пока не растворится анод, либо не используется вся соль сульфата меди СuSO4
Электродные процессы – процессы, связанные с переносом зарядов через границу между электродом и раствором. Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с растворением металла электрода.
|
|
|
№28.
Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП).
Ряд стандартных электродных потенциалов металлов (ряд напряжений металлов (см. табл.)) - последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение E°, тем большими восстановительными способностями обладает данный металл в виде простого вещества, и тем меньшие окислительные способности проявляют его ионы, и наоборот. Ряд стандартных электродных потенциалов представляет следующую информацию:
1)чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность и тем легче он окисляется;
2)каждый металл способен восстанавливать (вытеснять) из растворов солей те металлы, которые стоят в ряду стандартных электродных потенциалов после него;
3)чем более положительно значение электродного потенциала катиона, тем легче он восстанавливается.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 414; Нарушение авторских прав?; Мы поможем в написании вашей работы!