
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Моль це кількість г речовини, що чисельно дорівнює її молекулярній масі
|
|
|
|
Моль і М
Кількість речовини. Одиниця кількості речовини. Число Авогадро
Атомна одиниця маси (а.о.м., або дальтон) — позасистемна одиниця маси для представлення мас мікрочастинок (молекул, атомів, атомних ядер і елементарних часток). Офіційно рекомендуються англомовні терміни atomic mass unit (amu, атомна одиниця маси) і точніший — unified atomic mass unit (u, універсальна атомна одиниця маси), але в україномовних наукових і технічних джерелах «а.о.м.» вживається частіше.
Кількість речовини визначається числом структурних одиниць (атомів, молекул, іонів або інших частинок) цієї речовини. Для вимірюваний кількості речовини в хімії використовують одиницю, що носить назву моль.
Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів тощо), скільки атомів містить 12 г вуглецю. Кількість структурних одиниць (молекул, атомів, іонів, електронів), що містить один моль речовини, дорівнює N = 6,02·1023. Ця величина носить назву числа Авогадро.
Маса одного моля даної речовини в грамах має назву молярної маси. Молярна маса - це маса одного моля речовини, тобто така її кількість, в якій міститься стільки ж атомів, скільки в 12 г вуглецю. По-іншому, така кількість називається числом (або постійною) Авогадро. Відповідно до неї в рівних об’ємах ідеальних газів (при однакових температурі і тиску) повинно міститися однакове число молекул.
Молярну масу вимірюють у грамах на моль (г/моль). Чисельно вона дорівнює молекулярній (або атомній чи еквівалентній) масі речовини.
Молекулярна маса речовини дорівнює сумі атомних мас елементів, що входять до складу молекули.
М = моль/л це концентрація речовини
| 1 моль = 103 ммоль або mmol 1 моль = 106 мкмоль або μmol 1 моль = 1012 наномоль або nmol | 1 мілімоль = 10-3 моль 1 мікромоль = 10-6 моль 1 наномоль = 10-9 моль |
|
|
|
Ферменти. Ферменти — це речовини білкової природи, які забезпечують нормальне протікання (каталіз) всіх хімічних реакцій в живому організмі. Однією з найбільш характерних властивостей ферментів є їх висока субстратна специфічність. Це означає, що фермент діє чітко тільки на одну речовину (абсолютна специфічність) або на невелику кількість близьких по будові речовин, що мають однакову функціональну групу з якою і взаємодіє фермент (широка субстратна специфічність). Ступінь специфічності може значно змінюватися у різних ферментів.
Вивчення специфічності ферментних білків дозволило встановити, що субстрат з¢єднується не зі всією молекулою фермента, а з її окремою частиною, що називається активним центром фермента. Реакція, яку каталізує фермент протікає в такому центрі. Активний центр може знаходитися між субодиницями фермента або в заглибленні. Поверхня активного центру комплементарна по формі субстрату який туди входить, там знаходять групи елементів, що утворюють водневі зв¢язки з певними групами субстрату.
Ферментні білки, до складу яких входять атоми металів називаються металоферментами. Іони металів утворюють різного типу комплексні сполуки як з ферментним білком, так і з субстратом. До складу ферментних білків можуть входити катіони: Nа+, K+, Rb+, Cs+, Mg2+, Ca2+, Zn2+, Cd2+, Cr3+, Cu2+, Mn2+, Fe2+, Co2+, Ni2+ та Al3+ - всього біля 15 металів.
Роль атомів металу в роботі ферментного білку:
– метал є одним з компонентів каталітичного центру;
– атоми металу створюють або стабілізують просторову конформацію активного центру;
– атом металу активує ферментний білок;
– катіон металу пов¢язує активний центр ферменту з молекулою субстрату.
Білок і метал виявляють взаємний вплив. Наявність іону металу в молекулі ферменту впливає на електронний та структурний стан білку і, таким чином, змінює його властивості. З іншого боку, білок створює для металу незвичну стереохімічну просторову будову, що в свою чергу впливає на властивості металу. Біологічна функція деяких металів полягає в запасанні відповідних іонів металів. Такі білки як кональбумін яєчного білку, трансферин плазми крові, зворотно зв¢язують і переносять іони заліза, церулоплазмін переносить іони міді. Є білки, які контролюють концентрацію в організмі іонів кальцію, магнію, цинку на інших металів.
|
|
|
Атоми перехідних металів входять до складу ферментних білків, які беруть участь в ряді біологічних окисно-відновних процесів, задіяні в ферментних системах, що виконують функцію зберігання та транспорту кисню. Найбільш важливими є такі метали як залізо, мідь і кобальт, в меншій мірі, молібден. В реакціях окисно-відновні перетворення іонів металу лежать в основі певних каталітичних процесів, пов¢язані з переносом електронів, окисленням або відновленням субстратів.
Питома і молекулярна активність білків
Активність білку, що відноситься до одиниці маси білку називається питомою, а активність білку розрахована на молекулу – молекулярною.
Питома активність білків виражається частіше всього в мікромолях або в наномолях субстрату перетвореного за 1 хвилину 1 мг фермента.
Молекулярна активність білків виражається числом молекул субстрату, перетворених за одну хвилину однією молекулою ферменту або числом молекул субстрату, перетворених за одну хвилину одиним активним центром.
Цитохроми. Серед металоферментів залізовміщуючі ферментні білки ( гемопротеїн) є особливо важливими для біологічних процесів. Такі білки називають цитохромами або «клітинними пігментами» (вперше виявлені в кінці ХІХ століття). Термін «цитохром» означає (cito -клітина; сhromos -колір). В природі відомо 25-30 різних цитохромів. Всі вони позначаються буквами a, b, c, P і т.д.
Представники цього класу відповідальні за транспорт та зберігання кисню (гемоглобін, міоглобін), перенесення електронів (цитохроми), каталіз окисно-відновних реакцій (оксидази та пероксидази), каталіз розкладення пероксиду водню (каталази). Ізоформи цитохрому Р-450 локалізовані в різних органах та тканинах організму.
|
|
|
Відомо, що білки діляться на прості (при гідролізі утворюють тільки амінокислоти) та складні (при гідролізі утворюють, крім амінокислот, органічні або неорганічні сполуки). Небілкова частина складного білку називається простетичною групою. Цитохроми мають простетичну групу, у складі якої є атоми заліза (гемовий білок). Простетична група, що міститься атом заліза, називається гемом, а білки, що мають гем - гемовими.
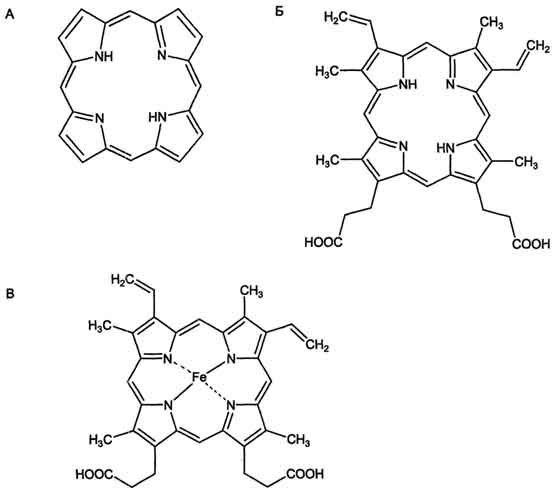
Будова порфирину (А), протопорфирину (Б) і гема гемоглобіну (В)
Порфирин - циклічна структура, що складається з чотирьох пірольних кілець, пов'язаних між собою метановими містками.
Протопорфирин (Б) має чотири метильных, два вінільних радикала та два залишки пропіонової кислоти.
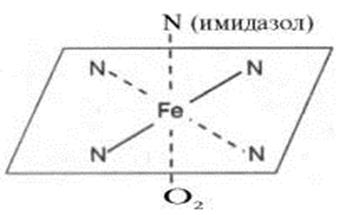
У гемі гемоглобіну атом Fe2+ утворює дві ковалентні та дві координаційні зв'язки з атомами азоту пірольних кілець протопорфирину (Б), а залізо Fe2+ легко віддає електрони і переходить в окиснений стан:
Fe+2 ¾ е- ® Fe+3
відновлений стан окиснений стан
(При віддачі електронів атом переходить в окиснений стан, процес називається окисненням, при приєднання електронів – атом відновлюється, процес називається відновленням)
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 945; Нарушение авторских прав?; Мы поможем в написании вашей работы!