
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Крива титрування сильної кислоти сильною основою
|
|
|
|
Криві титрування
У процесі кислотно-основного титрування відбувається безперервна зміна рН розчину. Крива титрування - графічне зображення зміни рН розчину в процесі його титрування. Розглянемо деякі типи кривих титрування в методі нейтралізації.
Нехай титрують розчин сірчаної кислоти (с(|Н2SО4)=0,1моль/л) розчином лугу (c(NaOH) = 0,1моль/л). У процесі титрування (нейтралізації) концентрація водневих іонів (а також рН середовища) змінюється. До початку титрування концентрація водневих іонів у розчині сірчаної кислоти дорівнює 0,1 (10-1)моль/л. Отже, рН цього розчину 1. Коли 90% початкової кількості еквівалента цієї кислоти буде відтитровано, Н+ іонів залишиться 10% (0,1) від початкової кількості, тобто 0,1 моль/л-0,1 = 10-2моль/л, рН розчину в цей момент дорівнює 2. При нейтралізації 99% початкової кількості еквівалента сірчаної кислоти концентрація іонів Н+ зменшиться до 0,1моль/л-0,01 = 10~"'моль/л; це відповідає значенню рН = 3. Подібним чином знаходять, що при нейтралізації 99,9% початкової кількості еквівалента кислоти у розчині залишається всього лише 0,1моль/л-0,001 = 10-4моль/л іонів водню, а рН розчину збільшується до 4. У момент повної нейтралізації H2SO4 концентрація іонів водню стає рівною 10" моль/л, а рН = 7. Додавання до титрованого розчину надлишку лугу веде до збільшення рН розчину. Після додавання надлишку (0,1%) розчину лугу (c(NaOH) = 0,1 моль/л) молярна концентрація іонів гідроксиду буде рівною 0,1моль/л-0,001 = 10-4моль/л (рОН = 4), а рН = 14 - 4 = 10. При додаванні надлишку (1%) розчину їдкого натру (c(NaOH) = 0,1 моль/л) концентрація іонів ОН" збільшиться в 10 разів: с(ОН~) = 0,1 моль/л·0,01 = 10^моль/л (рОН = 3), а рН = 14 - 3 = 11; і, нарешті, після додавання надлишку лугу (10%) (c(NaOH) = 0,1 моль/л) концентрація іонів ОН" збільшиться до с(ОНГ) = 0,1 моль/л-0,1 = 10~2моль/л(рОН = 2), арН = 14-2= 12.
|
|
|
Крива титрування, побудована на основі цих даних зображена на рис. 4. Характер кривої мало змінився б, якби при обчисленнях враховувалися б зміни об'єму розчину в процесі титрування.
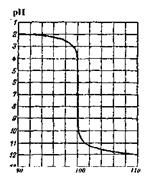
Молярна частка еквівалента доданого лугу від еквівалентної кількості лугу, %
Рис. № 4. Крива титрування сильної кислоти лугом
Аналіз кривої титрування показує, що спочатку рН розчину змінюється поступово, а поблизу точки еквівалентності - дуже швидко, а потім знову поступово. Особливо різко змінюється рН в інтервалі, коли залишилось 0,1% еквівалентної кількості недо-титрованої H2SO4 (рН = 4) і коли додано 0,1% надлишку від еквівалентної кількості лугу(рН= 10).
Стрибок титрування - різка зміна рН розчину, що спостерігається поблизу точки еквівалентності, тобто в кінці титрування. Стрибок рН на кривій титрування в даному випадку лежить в межах 4 - 10. Необхідно зауважити, що чим менша концентрація титрованого розчину, тим менший стрибок титрування. Така різка зміна рН розчину, що титрують, відбувається практично при додаванні однієї краплі титрованого (робочого) розчину. Точці еквівалентності у цьому випадку відповідає нейтральне середовище (рН = 7), тому що в цей момент у розчині знаходиться лише сіль Na2SO4, яка не гідролізує.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1808; Нарушение авторских прав?; Мы поможем в написании вашей работы!