
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Властивості. Якщо тільки частина гідроксильних груп у молекулах основ обмінена на кислотні залишки молекул кислот
|
|
|
|
Основні солі
Якщо тільки частина гідроксильних груп у молекулах основ обмінена на кислотні залишки молекул кислот, то такі солі називають основними:
- Cu(OH)2 + HCl = Cu(OH)Cl ↓ + H2O
- Fe(OH)3 + H2CO3 = Fe(OH)CO3 ↓ + 2H2O
- 2Cu(OH)2 + H2CO3 = Cu2(OH)2CO3 ↓ + 2H2O
Основні солі у водному розчині дисоціюють на катіони металу і аніони гідроксилу і кислотні залишки. Таким чином, основна сіль ніби одночасно є і сіллю, оскільки вона утворює при дисоціації аніони кислотних залишків, і основою, бо утворює і гідроксид-аніони:
- Cu(OH)Cl
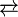 Cu2+ (aq) + OH− (aq) + Cl− (aq)
Cu2+ (aq) + OH− (aq) + Cl− (aq)
- Fe(OH)CO3
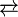 Fe3+ (aq) + OH− (aq) + CO32− (aq)
Fe3+ (aq) + OH− (aq) + CO32− (aq)
Обидві ці солі у воді практично нерозчинні, але розчинна їх частина дисоціює, за наведеними рівняннями. Іони гідроксилу основної солі при взаємодії її з кислотою теж можуть обмінюватись на кислотні залишки з утворенням нормальної солі:
- Cu(OH)Cl + HCl = CuCl2 + Н2О
Усі солі являють собою тверді кристалічні речовини. По відношенню до нагрівання деякі солі є досить стійкими. Наприклад: NaCl, KCl, Na2SO4 тощо. Ці солі можна нагрівати до температури їх плавлення і навіть кипіння, і вони не розкладаються. Інші ж солі нестійкі і при нагріванні розкладаються, не плавлячись. Наприклад:
- CaCO3 = CaO + CO2 ↑
За розчинністю у воді солі поділяють на добре розчинні, малорозчинні і практично нерозчинні. Добре розчинними є всі солі нітратної і ацетатної кислот, а також майже всі солі натрію, калію і амонію. До практично нерозчинних солей належать хлорид срібла AgCl, сульфат барію BaSO4, всі силікати (за виключенням NaSiO3 і K2SiO3) і ін.
Хімічні властивості солей визначаються їх відношенням до кислот, основ, металів і інших солей.
1. Солі можуть взаємодіяти з кислотами лише в тому випадку, коли реагуюча кислота сильніша за ту, від якої походить дана сіль. Наприклад:
|
|
|
- FeS + 2HCl = FeCl2 + H2S ↑
- Na2SiO3 + Н2SO4 = Na2SO4 + H2SiO3 ↓
2. Солі можуть взаємодіяти з лугами, коли внаслідок реакції утворюється нерозчинна основа або нерозчинна сіль. Наприклад:
- FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 ↓
- K2CO3 + Ba(OH)2 = 2KOH + BaCO3 ↓
3. Розчини солей можуть взаємодіяти з металами, коли даний метал в електрохімічному ряду напруги стоїть лівіше від металу солі. Наприклад:
- CuSO4 + Fe = FeSO4 + Cu
- HgCl2 + Cu = CuCl2 + Hg
4. Багато солей у розчинах можуть взаємодіяти одна з одною, коли одна із солей, що утворюється внаслідок реакції, є нерозчинною. Наприклад:
- Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓
- FeSO4 + BaCl2 = FeCl2 + BaSO4 ↓
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 410; Нарушение авторских прав?; Мы поможем в написании вашей работы!